
众所周知,因为口服制剂易于管理、稳定性好、生产工艺成熟、商品成本低,口服给药仍是药物给药途径的首要选择。对于口服给药药物递送策略来说,药物需要满足一定的口服生物利用度才能达到应有的药效,而药物在吸收部位溶解,将是决定药物吸收的重要因素。
难溶性药物犹如雨后春笋般涌现,限制了药物在胃肠道吸收部位的溶解,限制了口服药物的吸收,最终影响了新药开发的体内暴露问题,可能造成项目正常的往前推进受到影响。一个比较严峻的现实是,已上市品种中大约75%药物为难溶性药物,而处于研发产线中难溶性的占比更加突出,甚至在90%以上(图1)。

图1 基于BCS分类系统已上市品种药物的分类占比[1]
为了解决限制药物吸收的溶解度问题,提高药物的体内暴露,制剂科学家们探究了众多的增溶策略(图2),如原料粉碎,微粉甚至纳米化,环糊精包合技术以及在处方中加入助溶剂,潜溶剂,增溶剂,药物固态开发策略(包括多晶型筛选,盐型/共晶研究,无定形固体分散体制备)以及脂质制剂(如微乳,纳米乳等)。

图2 常见的难溶性药物增溶策略[2]
增溶策略众多,为了更好的有针对性的选择增溶策略,我们不妨从化合物的溶解过程去探究药物溶解的限速步骤。俗话说,知其然,知其所以然。了解化合物的溶解的原理(图3),针对其“症结”,“因病施治”,或许更容易“药到病除”。
图3a描述了溶剂-溶剂,溶质-溶质分子间的分离状态以及其与其他类型的分子的相互作用;图3b描述了溶质分子转移到溶液的过程,首先溶质分子需要从晶格中脱离,即要打破晶格能,脱离溶质分子之间的作用力,然后溶剂分子要空出容纳溶质分子的空间,即离解溶剂分子之间的相互作用(空化能);图3c溶质分子进入溶剂后,溶剂分子与溶质分子将发生稳定的相互作用,这个过程需要的能量称之为溶剂化能(溶剂通常为水性溶剂)。
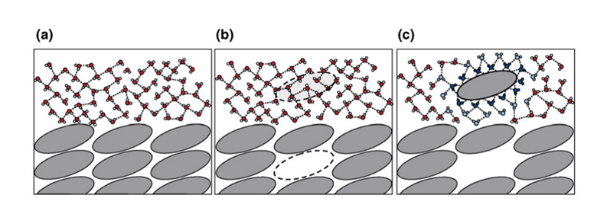
图3 化合物的溶解过程[3]
总结来说,一个晶体药物的溶解过程,涉及三种能量,即需要打破的晶格能,溶剂间空出空隙的空化能,溶质分子溶剂化的溶剂化能。一般认为,晶格能和溶剂化能能量要大于空化能,所以一个晶体化合物的溶解度较差通常认为与晶体药物溶解过程所涉及的晶格能和溶剂化能较强有关。
溶质分子间具有强的晶格能,限制了溶质分子的解离,这类化合物称之为“brickdust”,如石头般“顽固不化”。通常,使用化合物的熔点来显示其对于药物溶解度的限制,即熔点越高,晶格能越强,溶解度越低。熔点的临界值一般为200℃。
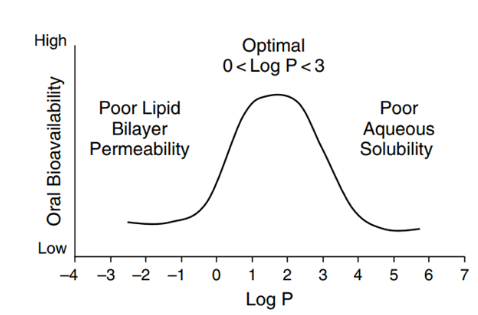
图4 LogP对于化合物口服生物利用度的影响[5]
溶质分子需要与溶剂分子相互作用,“水乳交融”,但是一般疏水化合物与溶剂分子作用有限,此类高疏水性的难溶性药物称之为“greaseball”,通常描述水化作用的参数为油水分配系数LogP,有建议将LogP2-3作为溶剂化能是否会限制晶体化合物溶解的临界值,看更多的资料发现,很多科学家更会把LogP在5以上作为临界值(图4,5),Lonza对于logP值低于5,而熔点过高,晶格结构限制化合物溶解度的化合物,推荐采用固体分散体技术,使稳固的晶体结构土崩瓦解,呈现无定形状态;当LogP高于5,水合能力较差,疏水性强,可以通过脂质制剂,助力形成亚微米乳穿过未搅拌的水层,提高疏水药物体内吸收。一个基本的认识就是LogP数值越大,化合物疏水性越强。对于可电离的化合物分子,可能使用LogD会更加的准确。
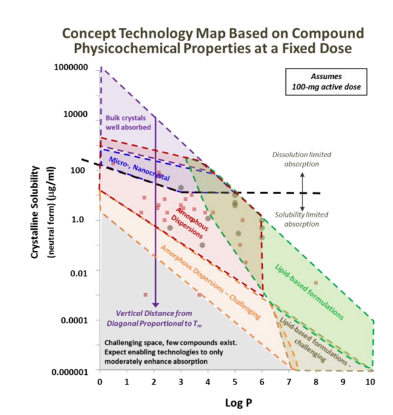
图5 Lonza基本化合物的熔点和LogP作为增溶策略的选择依据[6]
比较现实的问题,有些化合物可能兼具熔点高和LogP大的特点,大概可以推测出此化合物可开发性极差,很难通过增溶的技术达到目标的生物利用度,当然,药物分子在胃肠道吸收的过程和机制极其的复杂,尚需进行全面的研究。从上可知,化合物结构导致药物分子用于口服给药具有挑战性的物理化学特性,从药物溶解度的角度提炼出了化合物两个最基本的理化性质参数熔点和LogP,可用于表征化合物的溶解度限制因素,从而可以有针对性的选择增溶策略。
举例:特拉匹韦具有高度结晶性,熔点246°C且具有比较强的疏水性,logP为4.0,导致结晶药物水溶性极差(4.7μg/ml),其溶解度实际上低于大理石(14μg/ml)。初步制剂研究,表明溶液、混悬剂甚至纳米晶混悬剂导致特拉匹韦的口服暴露量非常低。特拉匹韦配制成无定形喷雾干燥分散体,显著提高了在水性介质中的动力学溶解度,最终提高了生物利用度。
难溶性药物越来越多,溶解度的下限不断地刷新,正如特拉匹韦的案例所示,有些化合物的溶解度甚至要低于大理石。正如图5所示,对于熔点较高,化合物溶解度极差,仅仅通过固态形式的改变(粒度较小甚至纳米晶等手段)很难克服;对于一些酸碱性的化合物来说,成盐在一定程度上可以提高药物的饱和溶解度,但是如何筛选合适的反离子以及药物本身的酸碱性极弱,造成所筛选的盐型易于发生歧化反应,这个问题遇到的几率再增加,而且还有可能牺牲药物的其他的性质。
固体分散体增溶手段从概念的提出到上市产品的应用,已经走过了60年以上的时间,理论逐步的完善,实践在很多的品种上获得了成功。无定形固体分散体将稳定的晶态药物转变为高能的无定形形态,提高了难溶性药物的溶解度,是克服药物难溶性的有效手段之一。当然,在解决问题的同时,同样也伴随着新的问题的发生,例如物理稳定性问题。高能态的无定形形式势必要自发的转向低能的稳定晶型状态,犹如水往低处流淌一样,但是随着高分子材料的开发与应用,在维持无定形的物理稳定性上,虽然不能阻断转晶的发生,但是却可以延长转晶发生的时间,以保证药品的货架期。
总结:上文我们阐明了目前药物研发遇到的拦路虎-药物的难溶性,而且情况很是严峻。虽然增溶策略众多,但是如何进行快速的有效的有针对性的选择增溶策略呢?为了明晰这个问题,我们又简单介绍了一个晶体药物的溶解度过程,明确了可能限制溶解度的化合物理化性质-化合物的熔点及LogP,接着我们引用了Lonza内部的一个增溶策略决策图,证实了化合物熔点和LogP可用于指导选择增溶策略,而且对于极其难溶的药物很难通过一般粒度控制策略去解决,最后我们强调了无定形固体分散体在解决难溶性药物的机遇与挑战。
本文更是像是一个前言或者引子,表明为什么会选择固体分散体技术以及它与其他增溶策略的不同点。后续文章,我们将针对固体分散体去谈固体分散体的一些特点和其如何去增溶,还请各位老师持续关注!
参考文献
[1] Di L , Kerns E , Carter G .Drug-Like Property Concepts in Pharmaceutical Design[J].Current Pharmaceutical Design, 2009.DOI:10.2174/138161209788682479.
[2] Patel K , Shah S , Patel J .Solid dispersion technology as a formulation strategy for the fabrication of modified release dosage forms: A comprehensive review[J].Daru : journal of Faculty of Pharmacy, Tehran University of Medical Sciences, 2022, 30(1):165-189.DOI:10.1007/s40199-022-00440-0.
[3] Bhattachar S N , Deschenes L A , Wesley J A .Solubility: it's not just for physical chemists[J].Drug Discovery Today, 2006, 11(21-22):1012-1018.DOI:10.1016/j.drudis.2006.09.002.
[4] Bergstrom,Christel,A,et al.Computational prediction of drug solubility in water-based systems: Qualitative and quantitative approaches used in the current drug discovery and development setting[J].International Journal of Pharmaceutics, 2018.
[5] Kerns E H , Di L .Drug-Like Properties: Concepts, Structure Design and Methods[M].Elsevier LTD, Oxford,2008.;等等
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论