
2022年已经过去,据药融云统计,在这一年中美国FDA一共批准了37款新药上市,其中包含22个新分子实体和15个新生物制品申请。这也是2017年以来,美国FDA批准数量最少的一年。在所有批准新药上市的药物中,抗癌药依旧占主体,多个重磅抗癌疗法陆续上市,给患者带来了更多选择。因篇幅有限,将分为两篇来发布。此篇先盘点前18款,后19款将放在下一篇(《2022年美国FDA批准新药上市的37款药物盘点(二)》)。
2022年美国FDA批准新药上市的37款药物
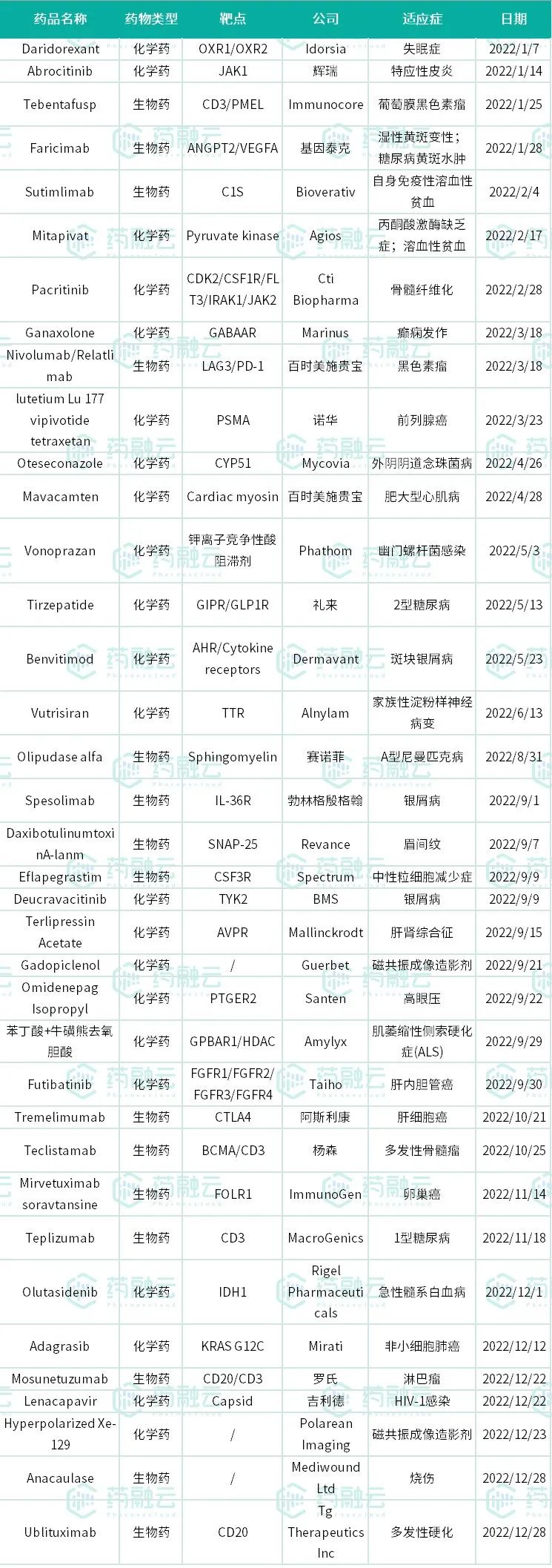
数据来源:药融云企业版数据库综合查询
资源下载
“药融云公众号(yrydata)”后台回复关键词“FDA2022”,即可获取《2022年FDA批准的新药》。
- 01.Quviviq(Daridorexant)
“Quviviq”(通用名:Daridorexant)为一款治疗失眠症的药物,它是一种双重食欲素受体拮抗剂(OXR)。治疗机制是通过竞争性结合OXR1和OXR2,抑制食欲素信号功能从而阻断觉醒通路以抑制过度活跃的失眠状态。该项批准是基于3期临床试验,共入组1854名成年人,结果显示与安慰剂组相比,药物组在入睡时间、睡眠持续时间以及总睡眠时间都有显著改善。
- 02.Cibinqo(Abrocitinib)
“Cibinqo”(Abrocitinib),是一种口服JAK抑制剂,用于治疗现有的全身疗法控制不充分的患有复发性中度至重度特应性皮炎的成人患者。临床3期结果显示:与安慰剂相比,药物组在疾病程度、疾病严重性及皮肤清洁程度上均有明显改善,且患者能在给药治疗两周后瘙痒症状得到快速缓解。该药在2021年已经在日本和欧洲获得了新药上市批准。
- 03.Kimmtrak(Tebentafusp)
“Kimmtrak”(Tebentafusp)是融合T细胞受体和抗CD3免疫效应结构域的双特异性融合蛋白疗法。以TCR技术为基础,通过靶向黑色素细胞和恶性黑色素瘤表达的gp100为目标,实现对癌细胞的靶向性杀伤。该药于1月25日获得FDA监管批准新药上市,是美国首个被用于治疗“HLA-A*02:01阳性不可切除或转移性葡萄膜黑色素瘤”的药物,也是首款T细胞受体(TCR)疗法。
- 04.Vabysmo(Faricimab)
“Vabysmo”(Faricimab)是一款治疗新生血管(湿性)年龄相关黄斑退化(nAMD)和糖尿病性黄斑水肿(DME)患者的可注射眼用药物。该药为首款获FDA批准新药上市的眼科领域双特异性抗体疗法,通过选择性的阻断VEGF-A和血管生成素-2(Ang-2)两条关键致病通路达到治疗疾病的作用。在临床试验中,约半数受试者的注射间隔延长至4个月,与当前标准治疗方法相比(间隔2个月注射的aflibercept),视力获益达到非劣效性标准。
- 05.Enjaymo(Sutimlimab)
“Enjaymo”(sutimlimab)是FDA批准的首款治疗冷凝集素病的单克隆抗体,剂型为注射剂,通过抑制红细胞的破坏(溶血),降低病人因溶血而致的红细胞(RBC)输血需求。该项批准是基于临床III期试验结果:Enjaymo达到了主要疗效终点,54%的患者达到主要复合终点。该品曾获得孤儿药、突破疗法和优先审评资格,目前在日本已经获批上市,欧盟新药上市申请正在进行中。
- 06.Pyrukynd(Mitapivat)
2022年2月17日,FDA批准了Agios的mitapivat用于治疗丙酮酸激酶(PK)缺乏的成人溶血性贫血(一种红细胞破坏速度大于生成速度的疾病)的新药上市申请。该药获得孤儿药资格、快速通道和优先审查资格。
Mitapivat的有效性在两项研究中进行了评估。一项是随机、双盲、安慰剂对照的临床研究,研究对象为80例未接受常规输血的成年PKD患者。另一项是单臂研究,研究对象为27例接受定期输血的成年PKD患者。
在随机研究中,mitapivat的有效性是基于血红蛋白反应,定义为研究开始时血红蛋白浓度增加≥1.5 g/dL,并在≥2次评估中保持稳定。血红蛋白浓度是用于测量红细胞未被破坏的数量。在研究结束时,40%接受mitapivat治疗的患者出现血红蛋白反应,而接受安慰剂的患者中无人出现血红蛋白反应。
在单臂研究中,mitapivat有效性基于输血负担的减少,定义为在过去24周的治疗中,与患者的既往输血负担相比至少减少33%的红细胞单位。33%接受mitapivat治疗的患者实现了输血负担的减少,其中22%的参与者在过去24周的治疗中不需要任何输血。
- 07.Vonjo(Pacritinib)
2022年02月28日CTI BioPharma Corp.宣布美国食品药品监督管理局(FDA)批准VONJO(pacritinib)用于治疗患有中度或高危原发性的成人或继发性(真性红细胞增多症或原发性血小板增多症后)骨髓纤维化。
加速批准新药上市是基于VONJO在骨髓纤维化患者中的关键3期PERSIST-2研究的疗效结果。患者按1:1:1随机分配接受VONJO 200 mg每日两次(BID)、VONJO 400 mg每日一次(QD)或最佳可用疗法(BAT)。允许先前的JAK2抑制剂治疗。
在这项研究中,在基线血小板计数低于50×10 9的患者队列中/L接受pacritinib 200 mg BD治疗的患者中,29%的患者脾脏体积减少至少35%,而接受包括芦可替尼(ruxolitinib)在内的最佳可用疗法的患者中有3%的患者脾脏体积减少了至少35%。作为加速批准的一部分,CTI需要在验证性试验中描述临床益处。为了满足这一批准后的要求,CTI计划完成PACIFICA试验,预计在2025年年中取得结果。
- 08.Ztalmy(Ganaxolone)
2022年03月18日,Marinus Pharmaceuticals公司宣布,美国FDA已批准Ztalmy(ganaxolone)加奈索酮口服混悬剂新药上市,用于治疗在2岁以上的患者中与细胞周期蛋白依赖性激酶样5(CDKL5)缺乏症(CDD)相关的癫痫发作。Ztalmy是首款获得FDA批准针对CDD患者群体的疗法。这一批准是基于一项随机双盲,含安慰剂对照的3期临床试验数据,共入组101例患者。在治疗第28天时,试验达到了主要终点,Ztalmy组患者主要运动癫痫发作频率的中位降低幅度为30.7%(p=0.0036),安慰剂组为降低6.9%。在开放标签扩展研究中,接受Ztalmy治疗至少12个月的患者(n=48),主要运动癫痫发作频率中位降低幅度为49.6%。安全性上,该3期试验中,Ztalmy通常耐受良好,并显示与既往临床试验一致的安全性特征,最常见的不良事件为嗜睡。
- 09.Opdualag(Nivolumab/Relatlimab)
2022年03月18日,百时美施贵宝宣布美国FDA批准其First-in-class双免疫疗法Relatlimab+Nivolumab固定剂量组合——Opdualag的新药上市申请,治疗罹患不可切除或转移性黑色素瘤的成人和儿童(12岁及以上)患者。Relatlimab是美国FDA批准的首款LAG-3抗体,也是近10年来针对全新免疫检查点获批的首款创新癌症免疫疗法。FDA本次对relatlimab的批准主要基于随机、双盲的Ⅱ/Ⅲ期临床试验RELATIVITY-047。RELATIVITY-047(CA224-047)是一项随机、双盲、II/III期研究,用于评估relatlimab联用Opdivo相较于Opdivo单药治疗既往未经治疗的转移性或不可切除的黑色素瘤患者。
试验主要终点是无进展生存期(PFS),次要终点是总生存期(OS)和客观缓解率(ORR)。共有714例患者按1:1的比例随机接受relatlimab(160 mg)+Opdivo(480 mg)vs Opdivo(480 mg)进行静脉输注,每4周一次,直至疾病复发、出现不可接受的毒性或撤回知情同意。目前正在对次要终点OS和ORR进行随访。Opdualag™(nivolumab and relatlimab-rmbw)每次注射价格为$27,389在疗效方面,Relatlimab–Opdivo组的中位无进展生存期为10.1个月,而Opdivo组为4.6个月。Relatlimab–Opdivo组的12个月PFS率为47.7%,而Opdivo组为36.0%。在安全性方面,Relatlimab–Opdivo组和Opdivo组分别有18.9%和9.7%的患者发生3级或4级治疗相关不良事件。
- 10.Pluvicto(Lutetium Lu 177 vipivotide tetraxetan)
2022年03月23日,诺华宣布,美国FDA已经批准该公司的靶向放射性配体疗法Pluvicto(lutetium Lu 177 vipivotide tetraxetan)新药上市,用于治疗前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)患者,这些患者先前已经接受过基于紫杉烷的化疗和雄激素受体信号通路抑制剂治疗。
这一批准是基于一项关键性3期临床试验的积极结果。试验结果显示,与标准治疗相比,添加Pluvicto将患者的死亡风险降低38%,Pluvicto同时显著降低患者出现放射学疾病进展或死亡的风险。而且,在基线携带可评估疾病的患者中,Pluvicto组的总缓解率为30%,标准治疗对照组这一数值为2%。
- 11.Vivjoa(Oteseconazole)
2022年04月26日,FDA官网显示FDA已批准Mycovia Pharmaceuticals公司开发的口服抗真菌药物Vivjoa(oteseconazole)的新药上市申请,用于在不具有生殖潜力的女性中,降低复发性外阴阴道念珠菌病(RVVC)的复发几率。
这一批准是基于3项3期临床试验的积极结果的支持,包括2项全球性的VIOLET试验和1项在美国进行的ultraVIOLET试验,一共入组870多例患者。两项VIOLET试验均达到其主要终点和关键次要终点。在为期48周的试验中,超过90%的患者接受oteseconazole治疗后能够有效预防感染复发(p<0.001)。
此外,ultraVIOLET试验也达到其所有主要终点与关键次要终点。试验结果表明,oteseconazole治疗VVC初始发作有效,并与目前标准治疗相比,进一步证明了其治疗RVVC的疗效和安全性。到50周时,治疗组复发率为5.1%,对照组为42.2%(p<0.001)。并且,oteseconazole可保护95%的受试者近一年不复发。期待这款新药能够为女性患者带来新的治疗选择。
- 12.Camzyos(Mavacamten)
2022年04月28日(新泽西州普林斯顿),百时美施贵宝(BMS)公司宣布,其“first-in-class”心肌肌球蛋白别构抑制剂Camzyo(mavacamten)获得美国FDA批准新药上市,用于治疗梗阻性肥厚型心肌病(oHCM)成人患者。
这一批准是基于关键性3期临床试验EXPLORER-HCM的结果,EXPLORER-HCM 3期试验是一项双盲、随机、安慰剂对照、平行组试验,共招募了251名有症状(NYHA II或III级)阻塞性肥厚性心肌病的成年患者。
EXPLORER-HCM的主要终点是复合功能终点,在30周评估,定义为混合静脉氧分压(pVO 2)改善≥1.5 mL/kg/min的患者比例NYHA分级至少1级或pVO 2提高≥3.0 mL/kg/min且NYHA分级无恶化。与安慰剂组相比,Camzyos组在第30周达到主要终点的患者比例更高(分别为37%和17%,差异为19%(95%CI:9、30;p=0.0005)。在第30周,与安慰剂组相比,接受Camzyos的患者在所有次要终点方面都有更大的改善。
- 13.Voquezna(Vonoprazan/Amoxicillin/Clarithromycin;伏诺拉生+阿莫西林+克拉霉素)
2022年05月03日Phathom宣布美国食品和药物管理局(FDA))批准了VOQUEZNA™TRIPLE PAK™(vonoprazan,amoxicillin,clarithromycin)伏诺拉生片剂、阿莫西林胶囊、克拉霉素片剂和VOQUEZNA™DUAL PAK™(vonoprazan,amoxicillin)伏诺拉生片剂、阿莫西林胶囊用于治疗成人幽门螺杆菌感染。
这些批准基于PHALCON-HP 3期试验的安全性和有效性数据,这是美国有史以来在幽门螺杆菌中进行的最大的注册试验,随机分配了1,046名患者。在改良的意向治疗人群中,两种VOQUEZNA治疗方案在基线时无克拉霉素或阿莫西林耐药性幽门螺杆菌菌株的患者中均表现出不劣于兰索拉唑三联疗法。
- 14.Mounjaro(Tirzepatide)
2022年05月13日,礼来宣布,美国FDA批准该公司葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂Mounjaro(tirzepatide)替西帕肽注射剂新药上市,每周注射1次,辅助饮食和运动,以改善成人2型糖尿病患者的血糖控制。
此次批准是基于III期SURPASS的项目积极结果,其大型III期项目由10项临床试验组成,计划招募超过13000例2型糖尿病患者,其中5项试验是全球性的注册研究。其中包括与司美格鲁肽1 mg、甘精胰岛素和德谷胰岛素的活性对照研究。这些研究评估了Mounjaro(5mg10mg和15mg)单独使用或与常用的糖尿病处方药物(包括二甲双胍、SGLT2抑制剂、磺脲类药物和甘精胰岛素)联合使用的疗效。SURPASS项目中,Mounjaro 5mg剂量平均使受试者A1C减少1.8%-2.1%,10mg和15mg剂量平均使受试者A1C减少了1.7%-2.4%。
此外,Tirzepatide在减重方面也取得了成功,在III期SURMOUNT-1试验中,tirzepatide(5mg,10mg,15mg)治疗组患者第72周时的减重效果均显著优于安慰剂对照组,平均减重最高达到22.5%(24kg),而且15mg高剂量组有63%的患者减重达到20%以上。礼来表示将与FDA讨论并寻求这一适应症的监管批准。
- 15.Vtama(Benvitimod)
2022年05月24日,Dermavant Sciences公司宣布,美国FDA已批准Vtama(1%tapinarof)本维莫德每日1次乳膏用于外用治疗斑块状银屑病成人患者的新药上市申请。这一批准包括所有银屑病患者,不论严重程度如何,并且标签上没有使用持续时间和使用身体部位的限制。
在两项关键性3期临床试验中,tapinarof达到所有的主要和次要终点,名为PSOARING 1的临床试验中,36%接受tapinarof治疗的患者达到皮肤症状清除或接近清除的标准,对照组这一数值为6%。在另一项3期临床试验中,这两个数值分别为40%和6%(p<0.0001)。在长期扩展研究中,获得皮肤症状完全清除的患者在停药之后可平均维持皮肤光洁或接近光洁4个月。为期52周的长期疗效数据显示,接受tapinarof乳膏治疗的成人斑块状银屑病患者,在疗效结果、生活质量方面均获得持久改善,未出现疗法失效的情况。长期扩展试验的患者满意度数据显示,81.7%的患者认为这款疗法比以前用过的外用疗法更为有效。
- 16.Amvuttra(Vutrisiran)
2022年06月13日,Alnylam公司宣布,美国FDA批准首款皮下注射RNAi疗法Amvuttra(vutrisiran)新药上市,用于治疗遗传性转甲状腺素蛋白介导(hATTR)的淀粉样变性成人患者的多发性神经病(polyneuropathy)。FDA的批准该药是基于HELIOS-A 3的随机、开放标签、全球性3期临床试验结果。试验结果显示,Amvuttra达到主要终点,接受治疗9个月后,Amvuttra组的mNIS+7评分(评估神经病障碍的评分)与基线相比降低2.2点(意味着症状改善),而外部对照组评分增加14.8点(意味着症状恶化,p<0.0001)。9个月时,50%的患者与基线相比症状得到改善。Amvuttra同时达到试验的所有次要终点。并且在接受治疗后18个月时,疗效数据与9个月时一致。
- 17.Xenpozyme(Olipudase alfa)
2022年8月31日,FDA批准Genzyme公司的创新酶替代疗法Olipudase alfa新药上市,用于静脉输注治疗酸性鞘磷脂酶缺乏症(ASMD)的成人和儿童患者。Olipudase alfa为首个用于ASMD患者非中枢神经系统症状的药物。ASMD由于缺乏分解复杂脂质(称为鞘磷脂)所需的酶引起的一种罕见遗传病,影响最严重的患者有严重的神经系统症状,其他患者也容易因为呼吸衰竭而过早死亡。Olipudase alfa是一种酶替代疗法,有助于减少鞘磷脂在肝脏、脾脏和肺中的积累。
- 18.Spevigo(Spesolimab)
2022年09月01日,勃林格殷格翰宣布,美国FDA已批准选择性白细胞介素-36受体(IL-36R)抗体Spevigo(Spesolimab)的新药上市申请,用于治疗泛发性脓疱性银屑病(GPP)的发作。Spevigo(Spesolimab)是FDA批准的第1款GPP疗法,这一批准得到为期12周的关键性临床试验Effisayil 1的支持。53名GPP发作患者接受了Spevigo或安慰剂的治疗。接受治疗一周后,Spevigo组无可见脓疱的患者比例为54%,安慰剂组这一数值为6%。在Effisayil™1中,接受SPEVIGO的患者最常见的不良反应(≥5%)是虚弱和疲劳、恶心和呕吐、头痛、瘙痒、输液部位血肿和瘀伤以及尿路感染。
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论