脂质体纳米粒在临床应用方面取得了极大的成功。无论是小分子药物领域已经上市了二十余款制剂,还是近期RNA疫苗研制中发挥的关键作用,都显示出脂质体在药物应用领域的巨大潜力。该篇综述聚焦于脂质体纳米粒在临床中的应用。本文为第五部分,概述了脂质体纳米粒在疫苗方面的应用,并对脂质体的临床应用进行了总结。
本文译自Thai Thanh Hoang Thi 和 Nghia P. Truong等人的综述 Lipid-BasedNanoparticles in the Clinic and Clinical Trials: From Cancer Nanomedicine toCOVID-19 Vaccines,Vaccines 2021, 9, 359(5.Lipid-Based Nanoparticles for Vaccines & 6. Conclusions and FutureDirections)
5. 用于疫苗的脂质纳米粒
2019年底,中国湖北省武汉市出现肺炎患者。此后,2020年1月,确认引起肺炎原因是一种新型冠状病毒,其被命名为2019-nCoV。世界卫生组织(WHO)、中国当局和其他合作伙伴致力于了解病毒的性质、来源、预防和治疗。然而,COVID-19在世界范围内空前蔓延,严重影响着全球经济个体和社区健康。因此,不仅迫切需要拯救COVID-19患者,也需要开发疫苗。
基于核酸的疫苗已经得到了广泛关注,首个核酸候选疫苗已经进入临床试验。与传统的基于蛋白质的疫苗相比,核酸疫苗具有许多优势,例如易于合成、安全、有效的抗原操纵、成本和放大能力。然而,核酸存在一些固有的缺点。DNA具有低免疫原性,可能与人类基因组整合。RNA在生理介质中迅速降解,并在10分钟内通过肾小球滤过有效排出。尽管如此,RNA仍然被认为是开发各种疾病疫苗的最佳平台技术,包括非传染性疾病和传染性疾病。体外转录RNA疫苗表现出有效的抗原表达,其自身也能够实现佐剂的效果。通常在疫苗中添加佐剂以增强和延长免疫反应,但它们也有可能引起炎症副作用。因此,RNA疫苗正在成为一种有希望的候选疫苗,其自身具有佐剂的性质,其炎症副作用最小。用于疫苗输送的颗粒必须具有高负载能力、可持续释放、无泄漏,且制造简单。为了最大限度地提高这些候选疫苗的效力以及实现人类应用的有利指标,携带这些制剂的载体在疫苗效力方面发挥着重要作用。对于特定疫苗,仔细考虑合适载体对于其生产具有关键作用。以脂质体为载体,IncoxalV、Epaxal、Mosquirix和Shingrix已成功商业化为疫苗,这些脂质体包含病毒体流感疫苗、灭活甲型肝炎病毒、RTS、S抗原疫苗和糖蛋白E疫苗。LNP已经成为疫苗设计的理想候选,它们与病毒结构相似,具有类似病毒的尺寸,并且能够携带抗原和佐剂。
在疫苗的发展史中,佐剂同样重要,其已经促进疫苗处方及其效力取得重大进展。尤其是明矾(不溶性铝盐)被纳入许多儿童疫苗中,如DTaP(白喉、破伤风、百日咳)疫苗、肺炎球菌结合疫苗和乙肝疫苗。在2015年批准的其他疫苗中,有许多处方中包括佐剂。例如,AS01(MPL(一种天然衍生的TLR4配体)和QS21皂甙)、MF59和免疫刺激性寡核苷酸分别出现在Shingrix、Fluad和Heplisav中。此外,上市产品中还包括各种其他疫苗佐剂,包括AS04、RC-529、CpGODN、TLR9激动剂、TLR4激动剂和病毒体。这些疫苗证实,加入佐剂可以使疫苗更快、更成功地进入临床应用。此外,据报道,许多脂质具有很强的佐剂活性。特别是阳离子脂质,二甲基十八烷基溴化铵(DDA),可以使抗原在注射部位沉积,细胞抗原内化和抗原结合增强。因此,可以预期,由DDA制备的LNP本身就具有佐剂活性。事实上,Anderluzzi等人报道,由DDA构成的聚合物纳米颗粒、脂质体和固体脂质纳米颗粒的乳液显示出高抗原吸附效率、体外抗原传递、体内分布和高抗体反应。然而,免疫原性水平强烈依赖于处方类型。纳米粒子系统显示出较高的细胞摄取和抗原处理能力,而乳剂显示出较高的抗体反应。
在另一个案例中,LNPs被用作佐剂和mRNA的载体系统,以实现它们在免疫刺激中的协同效应。李等人用Pam3(与五肽相连的三棕榈酰-S-甘油基半胱氨酸)佐剂制备LNP,以携带用于癌症免疫治疗的mRNA。他们的结果表明,这种制剂触发了不同的TLR,增加了CD8+T细胞的数量,从而阻止了肿瘤的生长。因此,LNP载体中的佐剂和mRNA的结合可能是基于mRNA的癌症治疗的一个有前景的途径。
5.1.用于治疗性疫苗的脂质纳米粒
在保护能力、药代动力学、组织分布和靶向给药(树突状细胞和巨噬细胞)方面,LNPs和脂质体最适合用于基于RNA的疫苗。通过对1000多个候选药物的优化,得出的结论是,LNP是编码抗肿瘤疫苗抗原mRNA的合适载体。这种RNA LNP被设计用于逆转M2样巨噬细胞或其他免疫抑制表型,激活先天免疫,抑制其他可溶性免疫抑制因子,并诱导肿瘤浸润性淋巴细胞,由此采用免疫调节策略治疗恶性肿瘤(图6)。事实上,许多综述已经总结了许多与此主题相关的研究。在此,我们将重点关注已开发疫苗的临床试验,总结见表5。
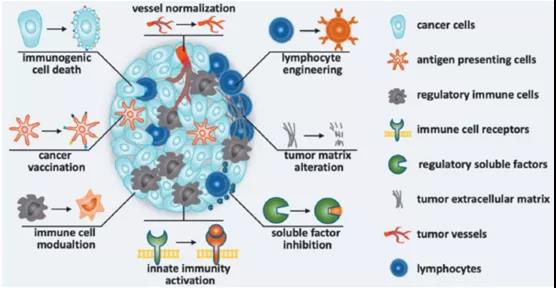
图6. 纳米药物采用的改善肿瘤免疫制粒的免疫调节策略
(纳米药物可以设计成诱导免疫原性细胞死亡、抗肿瘤免疫(肿瘤疫苗)、调节免疫细胞、激活固有免疫、抑制水溶性免疫抑制因子,改变肿瘤基质、工程化淋巴细胞和使血管正常化)
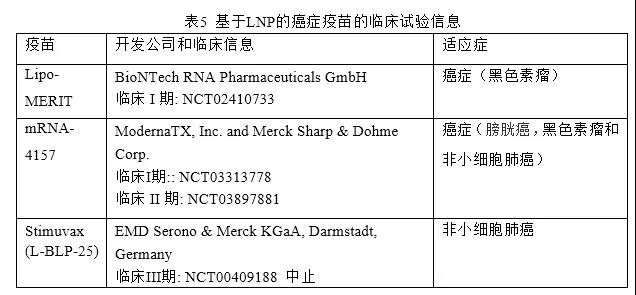
Lipo-MERIT是一种癌症疫苗,由编码NY-ESO-1、MAGE-A3、酪氨酸酶和TPTE的四种mRNA组成,这些mRNA被包裹在脂质体中,无需任何分子配体修饰。脂质体进入脾脏,被脾脏树突状细胞和巨噬细胞吸收,激活NK、B、CD4+和CD8+T细胞。LipoMERIT目前正处于临床I期。
另一种处于临床试验中的癌症疫苗是由ModernaTX和MerckSharp&Dohme开发的mRNALNP个性化癌症疫苗mRNA-4157。该疫苗适用于切除的实体瘤患者,包括膀胱癌、黑色素瘤和非小细胞肺癌(NSCLC)。此外,mRNA-4157还与帕博利珠单抗联合用于晚期或转移性癌症患者。给药后,这种LNP被抗原呈递细胞吸收和翻译,从而诱导细胞毒性T淋巴细胞和记忆性T细胞依赖性免疫反应来破坏癌细胞。目前,mRNA-4157处于临床I期(NCT03313778)和临床II期(NCT03897881),评价其安全性和有效性。
EMD Serono & Merck的Stimuvax(L-BLP-25,BLP25脂质体)也进入III临床试验(NCT00409188)。这种治疗性疫苗产生免疫,进而杀死表达糖蛋白抗原——粘蛋白1(MUC-1)的癌细胞。该试验针对晚期非小细胞肺癌(NSCLC)患者,但结果令人失望,未达到主要终点。因此,L-BLP-25被终止。
5.2.脂质纳米粒用于预防性疫苗——对COVID19的快速响应
2020年3月,世界卫生组织(WHO)宣布冠状病毒传染病(COVID-19)是一种全球性流行病。2021年3月,全世界报告了超过1.294亿例病例和280万死亡病例。同时,2019冠状病毒疾病有很高的几率成为季节性疾病,感染率高,潜伏期长。因此,COVID-19疫苗的研制已成为全球人口的必需品。为此,对许多平台进行了研究。FDA批准了12种疫苗。其他正在进行临床试验,目前有93种疫苗,共257项试验,其中,29种疫苗处于临床I期,39种疫苗处于临床II期,25种疫苗处于临床III期。大多数候选疫苗的激活机制是基于诱导针对刺突蛋白的中和抗体,以防止病毒通过人类血管紧张素转换酶-2(ACE2)受体被摄取到人类细胞。到目前为止,对于mRNALNP,只有mRNA-1273和BNT162开发成功,其他的正在进行临床试验。
BioNTech SE和辉瑞公司为SARSCoV-2疫苗开发的包埋mRNA的LNPs有四个候选药物(BNT162a1、BNT162b1、BNT162b2和BNT162c2)。它们由两种核苷修饰的mRNA设计,一种含尿苷的mRNA和一种自扩增RNA。在第II期临床试验(NCT04380701)和III期临床(NCT04368728)中,对18岁至85岁的健康志愿者进行了试验。BNT162b2候选疫苗已经完成了III期临床试验,证明其是安全有效的疫苗。在COVID-19疫苗的紧迫需求下,辉瑞和BioNTech向FDA提交BNT162b2的紧急使用授权申请。2020年12月11日,FDA批准Pfizer-BioNTech的COVID-19疫苗在美国销售。
mRNA-1273 COVID-19使用类似的策略,通过将mRNA包载在LNP中构建疫苗。这种合成的mRNA编码SARS-CoV-2病毒的尖刺,即S蛋白,它是病毒表面上通过ACE2受体与宿主细胞结合的关键因子。SARS-CoV-2病毒的S蛋白介导细胞附着、受体识别和病毒渗透和感染的融合。该疫苗由ModernaTX开发,正在FDA批准过程中(临床I期,NCT04283461)。它还进入了临床II期(NCT04405076),以评估18岁以上健康男性和未怀孕女性的反应原性、免疫原性和安全性。该候选药物已进入III期临床(NCT04470427),以评估安全性,有效性和免疫原性,以预防COVID-19长达两年。2020年12月17日,ModernaTX获得了FDA对mRNA-1273的紧急使用授权。
McKay等人研究了LNP包载自扩增RNA(saRNA)作为新的SARS-CoV-2疫苗,命名为LNP-nCoVsaRNA或COVAC1。相比于传统的mRNA,这些自我扩增的RNA结构可以更低剂量编码和制备任何感兴趣的抗原。在体外和体内实验中,针对SARS-CoV2的LNP-nCoVsaRNA疫苗表现出强大的抗体和细胞反应。这些耀眼的结果使人们强烈相信LNP-nCoVsaRNA疫苗将提高人类的免疫原性。目前,伦敦帝国理工学院将LNP-nCoVsaRNA疫苗应用于临床试验,目前处于临床I期(ISRCTN17072692)。
Duke-NUS Medical School和ArcturusTherapeutics合作共同开发了一种名为ARCT-021的COVID-19疫苗。他们使用LUNAR脂质介导的传递系统来包载RNA(STARRTM)。在临床前评价中,ARCT-021已被证明是一种安全有效的COVID-19疫苗。在不使用佐剂和病毒载体的情况下,它能够诱导CD8+T细胞和辅助性T细胞免疫应答。ARCT-021进入了I/II期临床研究(NCT4480957),在1–10μg的多剂量水平下进行了安全性、耐受性和免疫原性评估。本研究的年龄组为18-80岁的健康人群,孕妇和哺乳期妇女除外。ARCT-021的初步数据显示,在相对较低的剂量下具有良好的安全性。此外,其他类似的疫苗平台,包括ChulaCov19mRNA疫苗(ChulalongkornUniversity)和SARS-CoV-2mRNA疫苗已申请临床试验。ChulaCov19 mRNA疫苗已注册I期临床试验(NCT04566276),尚未招募病人。SARS-CoV-2mRNA疫苗已经申请中国临床试验注册中心的I期临床试验(ChiCTR2000034112)。本试验将评估18岁以上人群中多剂量的安全性、耐受性和免疫原性。
LNP正在开发的COVID-19疫苗不仅包括上述批准的产品或那些仍在临床试验中候选疫苗,而且还包括许多其他正在开发的临床前阶段的候选疫苗。世界各地许多公司、研究机构和大学已经被记载在WHO的关于RNA包载的LNP疫苗的列表中。GlobeBiotech开发了SARS-CoV-2 D614G变异体LNP包裹的mRNA。马克斯·普朗克胶体和界面研究所(MaxPlanck Institute of Gloids and Interfaces)的LNPs包载了靶向朗格汉斯细胞的mRNA。赛诺菲巴斯德和TranslateBio研究了基于mRNA的疫苗MRT5500,并将于2020年底申请临床试验。现在,MRT5500已开始I/II期临床试验。预计将在2021年第三季度取得中期数据。CanSinoBiologics和PrecisionNanoSystems合作开发了一种由mRNA和脂质纳米粒载体组成的COVID-19RNA疫苗。第一三共公司已经开发了基于mRNA的COVID-19疫苗,命名为DS-5670。对于接下来的临床研究中,第一三共将与东京大学合作。IMV(达特茅斯,加拿大)研制了他们的DPX-COVID-19候选疫苗。DPX是一种基于脂质的输送系统,其中肽抗原溶解在脂质中,最终配方以干燥形式储存。溶解后,该疫苗通过肌肉注射。注射部位没有释放机制,但肽抗原起到佐剂的作用,DPX可以招募抗原呈递细胞,从而诱导淋巴结的免疫反应。张娜等研究了一种预防COVID-19病毒感染的热稳定的mRNA候选疫苗。他们使用LNPs包载靶向SARS-CoV-2受体结合域(RBD)的mRNA。在他们使用的小鼠模型中,这种LNP诱导的中和抗体和T细胞反应对SARS-CoV-2具有高度的保护性免疫力。此外,该候选疫苗可在室温下储存至少一周。凭借这些优势,该LNP-mRNA候选疫苗(RQ3011-RBD)进入在复旦大学、上海交通大学和RNACureBiopharma进行的临床I期。此外,他们还设计了另外两种候选疫苗,RQ3013-VLP和RQ3012-Spike,其中包括mRNA构建的混合物。RQ3013-VLP候选疫苗包含编码S(峰)、M(膜)和E(包膜)3种病毒结构蛋白的mRNAs混合物。RQ3012-Spike疫苗携带编码全长野生型S的mRNA。在小鼠模型中,RQ3013-VLP在三个候选基因中表现出最好的免疫反应,而RQ3011-RBD在2μgRNA剂量的低浓度下诱导免疫力不足。根据这些初步试验,可以得出结论,mRNA疫苗可以作为一种灵活的平台,有效地设计候选疫苗。
此外,针对其他疾病的疫苗开发策略仍在研究中。Shi-rai等人证明LNPs可以作为流感疫苗的佐剂。与裸露的常规季节性裂解疫苗(SV)和SV联合明矾相比,包载SV的LNP对小鼠登革细胞的免疫刺激作用和保护能力的结果证实了这一点。LNP由1,2-二油基-3-三甲基铵-丙烷、1,2-二棕榈酰-sn-甘油-3-磷酸胆碱、N-(羰基甲氧基聚乙二醇2000)-1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺和胆固醇制成。结果发现,包载SV的LNP与SV结合明矾的效率类似。明矾引起高度炎症反应,这被认为是传统佐剂的局限性。相反,LNP能够诱导SV特异性免疫反应而无炎症。斯瓦米纳坦等人还评估了在小鼠模型中单独使用LNPs和加入合成TLR9激动剂IMO-2125佐剂的LNPs的佐剂活性。该LNP配方由DSPC、胆固醇、DMG-PEG2000和不对称可电离氨基脂质组成。令人惊讶的是,无佐剂的LNP能够诱导B细胞对HbsAg(乙型肝炎病毒表面抗原)和卵清蛋白亚单位抗原的反应,其水平与其他佐剂(包括IMO-2125、3-O-脱乙酰单磷酸脂和铝基佐剂)相当。与单独使用IMO-2125相比,LNP不仅能显著增强免疫应答,而且还能诱导更高的Th1型应答。因此,LNPs和免疫调节性寡核苷酸佐剂的组合可以形成免疫应答的协同效应,获得无机佐剂截然不同的免疫品质。
6. 结论和未来方向
脂质体纳米粒技术与化疗和核酸疗法的临床发展证明了脂质载体在一系列疾病治疗中的潜力。然而,已上市的成功产品数量并不准确代表(预)临床试验中的制剂数量,这表明这些纳米颗粒的开发在从动物到人类的转化过程中仍然面临困难和挑战。最近,为了克服这些限制,已经开发出一些策略。为了提高纳米粒的稳定性和防止药物泄漏,脂质结构被设计成通过离子吸引与被包载治疗药物形成复合体。电离脂质,如DOP-DEDA,已证明有利于基因包载。另一方面,胆固醇对脂质体结构的稳定性至关重要,从而导致药物的紧密包载。LNPs在生理介质和体循环中的稳定性是通过PEG脂质修饰颗粒表面实现的,从而减少网状内皮系统的识别。然而,已有报道第一剂量给药后产生抗PEG抗体,这会降低后续给药的治疗效果和或引起不良反应。因此,为了实现重复给药,寻求聚乙二醇替代品对是必要的。除了长时间的循环外,LNP必须针对靶向的组织细胞器官,然后通过细胞膜内化,在作用部位释放药物。为了达到这一要求,LNP被设计为具有选择性配体的智能材料,其降解由pH值、温度或氧化还原的变化触发。
LNP对靶细胞的选择性结合仍然是一个挑战。例如,核酸疫苗不能直接注射到我们的淋巴结或脾脏中,而淋巴结或脾脏是负责制造抗体和杀死癌细胞的免疫细胞所在的组织。因此,将核酸从注射部位定向输送到淋巴结或脾脏中的免疫细胞对于最大限度地产生抗体或长寿命抗原特异性细胞毒性T细胞至关重要。这种输送系统需要能够靶向淋巴结,但也需要穿过淋巴结中的屏障细胞与免疫细胞相互作用。此外,在内化后,必须开始有效地向异常细胞释放治疗药物。这些促进细胞摄取、内化和有效载荷释放的机制尚未达到预期效果。具有选择性配体的LNP的上市尚未成功。因此,利用各种细胞类型特异性配体和刺激剂,修正针对不同疾病的LNP,有望很快进入临床试验评价其有效性。与佐剂共递送或药物共包封是该领域的研究热点,可以改善疗效和免疫调节。此外,LNP的制造和放大生产一直具有挑战性。基于微流体的LNP制备新方法被认为是迄今为止最稳健的方法,但它在制备多功能LNP方面存在局限性。
同时,为了COVID-19疾病的防治,RNA和LNP疫苗的快速发展已经获得了FDA的紧急批准,这证明了这种方法能够快速有效地响应复杂疾病。这些疫苗不仅限于传染病,而且还用于癌症和高脂血症等其他疾病类型。一些临床试验几乎处于最后阶段。许多研究都处于早期阶段,并将在未来增加,预计一系列产品将投放市场。
总之,我们相信mRNA LNP疫苗的成功为LNP技术开启了激动人心的篇章。小分子药物和核酸给药的LNP制剂优化任重道远,LNP再次成为纳米药物给药系统的领跑者。本综述强调了从这条漫长道路中吸取的关键经验教训,并作为设计LNP的参考。为了应对当前的全球卫生挑战,仍然迫切需要进一步开发LNP,这需要不同领域科学家的合作努力。
参考阅读:
临床应用和临床试验中的脂质体纳米粒(四):基因治疗
<END>











































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论