1.3.1本周国内医药大健康行业政策法规速览

1.3.2本周重点行业政策详细说明
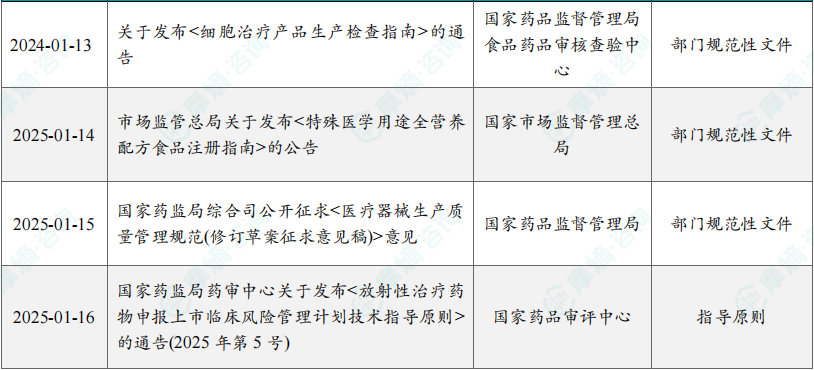
(1)国家药监局综合司公开征求《医疗器械生产质量管理规范(修订草案征求意见稿)》意见
1月15日,为进一步加强医疗器械监督管理,持续规范医疗器械生产行为,提升企业质量管理合规能力和水平,根据《医疗器械监督管理条例》《医疗器械生产监督管理办法》,国家药监局组织起草了《医疗器械生产质量管理规范(修订草案征求意见稿)》。该修订草案旨在进一步完善医疗器械生产质量管理体系,确保医疗器械产品的安全性、有效性和质量合规。通过提升企业的质量管理水平,强化监督检查,规范生产行为,推动行业健康发展。这一政策的实施将有助于提高企业的自律性,增强监管力度,有效防范质量事故,保障人民群众的生命健康。
(2)国家药监局药审中心关于发布《放射性治疗药物申报上市临床风险管理计划技术指导原则》的通告(2025年第5号)
1月16日,为指导放射性治疗药物申报上市时如何进行风险管理,药审中心组织制定了《放射性治疗药物申报上市临床风险管理计划技术指导原则》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。该技术指导原则的发布,旨在为放射性治疗药物申报上市提供科学、规范的风险管理框架,指导企业在临床研究和药物注册过程中,识别、评估和控制潜在风险。这一政策有助于确保放射性治疗药物的安全性和有效性,提高药品研发的透明度和合规性。
同期事件:
1. 2025年第3周01.13-01.19国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第3周01.13-01.19国内仿制药/生物类似物申报/审批数据分析
3. 2025年第3周01.13-01.19全球创新药研发概览
以上内容均来自{摩熵咨询医药行业观察周报(2025.01.13-2025.01.19)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论