
CRO虽然能帮助新药研发降成本、缩周期,但若不专业,也可能带来巨大损失。
“一家CRO出现了‘临床试验执行错误’,我们正在对其工作进行审计。这是一次挫折,耗费大量时间和金钱。”Acelyrin表示。

Acelyrin于2020年成立,是一家后期临床生物制药公司,专注于加速免疫学变革性药物的开发和交付。2023年5月在美国纳斯达克上市,融资了5.4亿美元,用来开发IL-17A抑制剂。现有药物包括Eli Lilly的Taltz和诺华的Cosentyx都作用于同一靶点,但Acelyrin说服投资者,其使用小蛋白而不是单克隆抗体,创造了一个具有更高效能的差异化资产。
Acelyrin在研管线
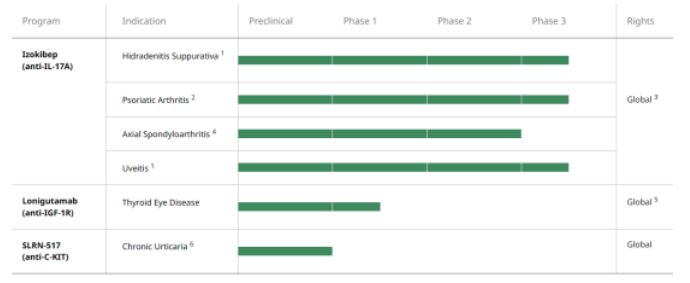
然事与愿违,2023年9月,Acelyrin公布核心管线IL-17类抗体Izokibep治疗化脓性汗腺炎2b/3期临床失败,当日股价遭受重击,大跌60%。Acelyrin目前市值8亿美元左右,截至2023年9月30日,公司拥有现金为7.9亿美元,表明公司有现金来度过挫折。
Izokibep基本信息

截图来源:全球药物研发数据库
2023年11月27日,Acelyrin提供了关于其izokibep临床开发计划的更新,包括其正在进行的针对牛皮癣性关节炎(“PsA试验”)的全球2b/3期试验。
背景
2023年9月,ACELYRIN公布了其2b/3期试验B部分评估izokibep治疗中度至重度汗腺炎性丘疹病(“HS试验”)的顶线结果。鉴于试验中观察到的某些混淆因素,包括无不良事件的受试者停药和后半段研究中安慰剂发生率的显著增加,公司实施了超出HS试验的标准协议的质量控制措施,包括正在进行的HS试验的开放标签延伸、正在进行的HS的3期试验和正在进行的PsA试验。这些试验由同一合同研究机构(CRO)进行。CRO不会代表ACELYRIN进行除izokibep临床计划外的任何试验。
PsA试验
正在进行的PsA试验设计有四个分组:每周160mg剂量(QW)、每两周160mg剂量(Q2W)、每四周80mg剂量(Q4W)和安慰剂。ACELYRIN的团队最近发现其CRO和CRO聘用的供应商之一存在临床试验执行错误。ACELYRIN已确认,规定剂量顺序的方案是正确的。然而,ACELYRIN的方案被供应商错误地编号,导致顺序错误,这在提供商的测试过程中进一步未被识别。因此,160mg Q2W和80mg Q4W分支的一些患者按随机顺序接受安慰剂和积极治疗,而不是按照预期的交替模式。重要的是,没有因顺序错误而对患者安全造成风险,并且没有患者接受比最常见的 160mg QW 给药组方案中已经包含的更积极的治疗。编号错误已得到解决,剂量顺序已得到纠正。
目前正在进行工作,以确定160mg Q2W 和 80mg Q4W 组中测序错误的影响。根据ACELYRIN迄今为止的审查,以及安慰剂和160mg QW组设计为每周给药一致的事实,公司没有理由相信160mg QW组和安慰剂组会受到影响。
后续步骤
ACELYRIN对正在进行的izokibep试验的广泛审查,包括CRO的操作执行,正在继续进行。ACELYRIN将与第三方签订合同,对CRO正在进行的ACELYRIN试验进行独立审计,包括HS试验和PsA试验。ACELYRIN不会将该CRO用于其进行的任何新试验。根据其正在进行的评估和计划的审计结果,公司将为患者确定izokibep开发的最佳路径。这将包括决定是否将其正在进行的试验移交给新的CRO,还是由当前的CRO完成试验。在第三方审计机构完成评估之前,ACELYRIN计划在2024年第一季度报告其PsA试验的最新数据。
该公司之前提交了一项非CRO进行的izokibep治疗PsA的2期试验的16周和46周的差异数据,每隔一周80mg。这些结果表明,剂量顺序的反应早在治疗一个月后就开始了,并随着时间的推移而增加。最近在美国风湿病学会年会上公布的同一试验的长期疗效结果显示,随着治疗时间的延长,患者在PsA的临床表现中经历了持久和加深的疾病消退,导致生活质量的进一步改善,这是由银屑病关节炎疾病影响问卷所衡量的。根据2期PsA数据建模预测,在80mg Q2W的基础上,更高的剂量可能会增加疗效。正在进行的PsA试验包括更高的剂量,旨在评估进一步最大化患者反应的潜力。
“我们对这些进展感到失望,特别是对于那些需要更好治疗银屑病关节炎和化脓性汗腺炎的患者,”ACELYRIN创始人兼首席执行官、医学博士Shao-Lee Lin说,“然而,我们是一家建立在真实和透明基础上的公司,我们很感激通过我们内部团队的坚韧,我们能够发现这些错误。我们致力于为患者,医生和股东提供最好的结果,因为我们继续追求izokibep作为多种免疫疾病的潜在差异化治疗方法的开发。”
由于这些进展情况不顺利,公司将不参加Piper Sandler于11月28日(周二)举行的第35届年度医疗保健会议或Evercore ISI HealthCONx于2023年11月30日(周四)举行的第6届年度会议。
关于Izokibep
Izokibep是一种小蛋白治疗药物,旨在通过紧密结合亲和力来高效抑制IL-17A,由于其小分子大小,约为单克隆抗体大小的十分之一,并且具有延长半衰期的白蛋白结合结构域,因此具有强大的组织渗透潜力。临床试验数据支持这样的假设,即izokibep的这些独特特征可能为患者提供有临床意义和差异化的益处,包括解决疾病的关键表现。Izokibep正在多个中重度化脓性水疱炎(HS)、银屑病关节炎(PsA)和葡萄膜炎的后期试验中进行评估,并计划启动另一个用于轴性脊柱炎(AxSpA)的3期临床试验。Izokibep最初由Affibody研发,2021年11月,Acelyrin引进该产品的部分权益,支付2500万美元预付款以及3亿美元里程碑金额。创响生物拥有大中华区权益。
参考:
药融云数据库
公司官网
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论