2021年12月31日,国家药品监督管理局(NMPA)正式批准恒瑞医药自主研发的1类新药羟乙磺酸达尔西利片(商品名:艾瑞康®)上市。此次与达尔西利(研发代号:SHR6390;英文Dalpicilib)同时获批的还有恒瑞医药的降糖1类新药脯氨酸恒格列净片。药融云数据显示:截止目前,恒瑞医药在国内上市的创新药增至10款。
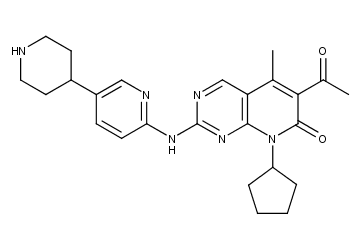
Dalpicilib结构式
达尔西利(Dalpicilib)是首个中国国产原研CDK4/6抑制剂,本次获批适应症为联合氟维司群用于激素受体(HR)阳性,人表皮生长因子受体2(HER2)阴性的经内分泌治疗后进展的复发或转移性乳腺癌的治疗。达尔西利能够选择性地抑制CDK4/6激酶活性,进而阻断CDK4/6-Rb信号通路、诱导细胞G1期的阻滞并选择性地抑制Rb高表达肿瘤细胞的增殖。因此在细胞由G1期进入S期的过程中起着决定性的阻断作用,从而发挥抑制肿瘤细胞的增殖、达到抗肿瘤的作用。截止2022年1月,达尔西利相关项目累计已投入研发费用约 36,359 万元。本品化合物专利为WO-2014183520;结构与辉瑞的结构相似。
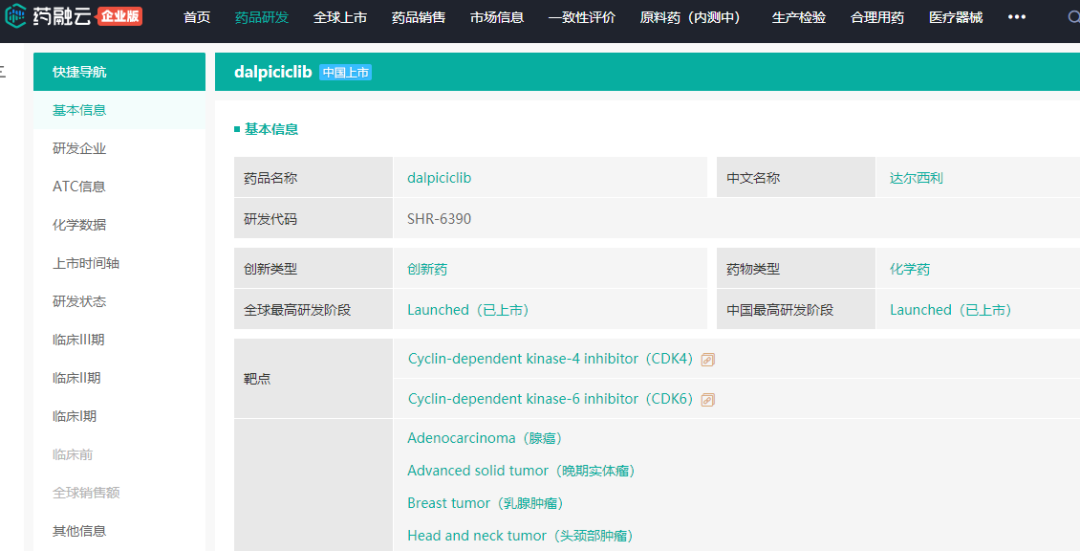
截图来源:药融圈旗下药融云全球药物研发数据
该新药上市申请(NDA)于2021年4月被国家药监局按突破性治疗品种纳入优先审评审批程序。此次达尔西利获批,主要是基于DAWNA-1研究 :一项多中心、随机、对照、双盲Ⅲ期临床研究,旨在对比达尔西利与安慰剂加氟维司群治疗既往经内分泌治疗复发或进展的HR+/HER2-晚期乳腺癌患者。DAWNA-1研究入组的361例患者100%为中国患者。按照 2:1 随机入组,分别接受达尔西利或安慰剂联合氟维司群治疗,每 28 天为一个治疗周期,其中前 3 周连续服药达尔西利或安慰剂,后1周休息(不服药),治疗直至疾病进展、毒性不可耐受或其他需要终止治疗的情况。主要研究终点是根据 RECISTv1.1 标准评估的无进展生存(PFS),次要研究终点包括无进展生存期(PFS)、总生存期(OS)、总缓解率(ORR)、临床获益率(CBR)、客 观缓解持续时间(DOR)和安全性。。研究结果显示,与安慰剂组相比,达尔西利组患者中位无进展生存期(mPFS)延长了8.5个月(15.7个月 vs 7.2个月,HR=0.42)。在预设亚组中,PFS获益均一致倾向于达尔西利组。
截止目前,药融云数据显示:全球范围内共有5款CDK4/6抑制剂新药获批上市,分别为辉瑞的Ibrance(Palbociclib)、诺华的Kisqali(Ribociclib)、礼来的Verzenio( Abemaciclib)、 G1 Therapeutics Trilaciclib以及恒瑞医药的Dalpicilib。其中多款已经在华获批,且进入医保目录。
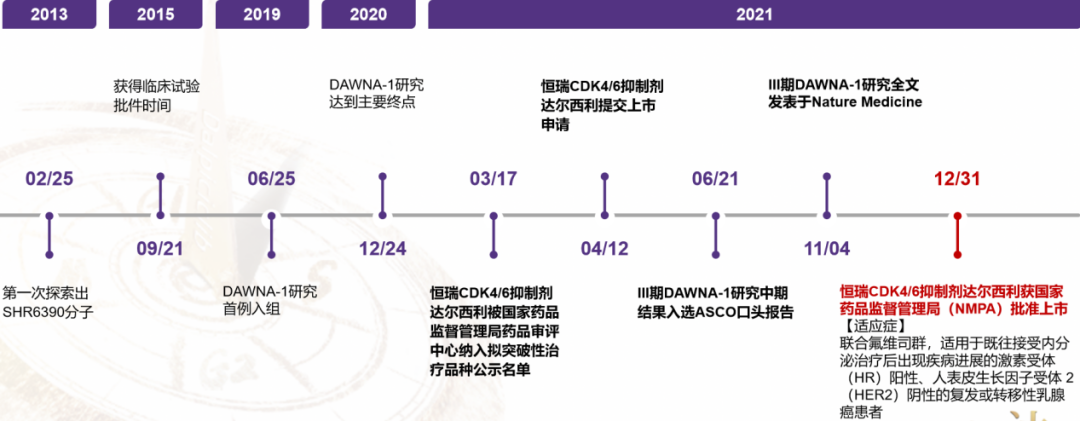
Dalpicilib新药研发时间轴,始于2013年的候选分子
2022年2月26日,达尔西利(艾瑞康®)上市会在全国13个城市召开。目前本品已在全国上市。药融圈获悉,本品150mg*21片*1盒价格为13500元人民币。随着竞争加剧、时间推移以及进医保策略,笔者预计本品将有大幅降价趋势。
乳腺癌是世界范围第二大常见肿瘤,是女性最常见的恶性肿瘤之一。目前国内患者乳腺癌发病率增长迅速,在一些大城市已经位列女性肿瘤发病谱首位,并且近50%患者出现治疗后复发和转移。内分泌治疗为激素受体阳性(HR+)女性乳腺癌患者的标准治疗,但内分泌治疗的原发性和继发性耐药常常导致治疗失败。在大部分肿瘤中,各种遗传或表观遗传学的改变引起CDK4/6的高活性,进而过度磷酸化和抑制Rb蛋白,最终导致了细胞的无序增殖。临床研究证实超过一半的乳腺癌患者过表达细胞周期蛋白D,且大部分为雌激素受体阳性(ER+)乳腺癌患者。细胞周期蛋白D直接作用于细胞周期依赖性蛋白激酶4/6(CDK4和CDK6)。因此,CDK4和CDK6成为HR+阳性转移性乳腺癌(mBC)患者的重要分子靶点。
参考:
NMPA/CDE;
药融云数据,https://www.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
各公司披露信息;
恒瑞医药官网;等等。
想要解锁更多药企创新药最新信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药申报情况、最新进展、研发阶段、临床试验、竞争格局、售卖价格、涉及靶点适应症、销售情况、市场规模与前景,可否投入研发与仿制!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>






























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)









 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论