随着GMP对药品安全生产要求的不断提高,质量管理体系需要不断加强药厂洁净区环境监测,因此面对不断提高的环境质量要求,质量管理部门应加深对环境监测的质量认识,掌握环境监测的技术手段,定期评估环境监测程序的有效性和完整性,并且对环境监测数据进行趋势分析以寻找可以更好控制的区域。
1.定义
1.1洁净室(区):对悬浮粒子及微生物污染规定需进行环境控制的房间或区域。其建筑结构、装备及其使用均具有减少对该区域内污染源的介入、产生和滞留的功能。
1.2警戒限度:系统的关键参数超出正常范围,但未达到纠偏限度,需要引起警觉,可能需要采取纠正措施的限度标准。
1.3纠偏限度:系统的关键参数超出可接受标准,需要进行调查并采取纠正措施的限度标准。
2.洁净区分级
2.1 A级:高风险操作区,如生产车间的灌装区、放置胶塞桶和无菌装配或连接操作的区域等;无菌检查、微生物限度检查操作区域等。
2.2 B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域;无菌检查操作区所处的背景区域。
2.3 C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区;微生物限度检查操作区所处的背景区域等。
3.监控项目及方法
定期对洁净区进行风量、压差、温湿度、悬浮粒子、微生物(包括沉降菌、浮游菌和表面微生物)项目监测,根据监控数据评价环境的状况。
3.1风量
Ø 测试方法:静态条件下进行测试,采用风量罩套取每间洁净区房间高效过滤器送检测风风量。制剂车间洁净区风量每季度测试一次,其他洁净区风量每半年测试一次。
Ø 采样点:洁净区每间房间高效过滤器。
Ø 可接受标准:根据房间面积换算换气次数,与设计风量和换气次数进行比对应在设计范围内,并符合洁净级别的要求。
3.2压差
Ø 测试方法:
(1)静态测试:静态条件下进行测试,运用压差计测量相邻房间的压差,由设备动力科联系外包单位进行测试。制剂车间洁净区静压差每月测试一次,其他洁净区静压差每半年测试一次。
(2)动态测试:生产前对挂有压差表的房间进行压差读数并记录,每天由车间工艺员进行记录。
Ø 采样点:
(1)静态测试:相邻房间之间的静压差。
(2)动态测试:挂有压差表的房间。
Ø 可接受标准:洁净区与非洁净区之间、洁净级别不同的相邻房间之间的静压差应大于10帕。
3.3温湿度
Ø 测试方法:采用关键操作房间内放置温湿度表显示数值,每日生产前进行读数并记录。
Ø 采样点:关键操作房间。
Ø 可接受标准:一般温湿度应控制在温度18~26℃、相对湿度控制在45~65%,特殊情况根据不同产品生产工艺规定要求。
3.4悬浮粒子
Ø 测试方法:
(1)静态测试:使用仪器①PMS的悬浮粒子采样器,型号:LASAIR-Ⅲ350L;②PMS的悬浮粒子采样器,型号:LASAIR-Ⅲ5100。
(2)动态测试仪器:在线粒子监测系统。
(3)采样前先确认洁净区通风系统运行平稳后,方可进行取样。
(4)具体采样方法参照《医药工业洁净室(区)悬浮粒子的测试方法》现行国家标准中的有关方法进行测试。
Ø 采样点:
(1)任何洁净区内取样点应不少于两个。
(2)除受洁净区的设备限制外,取样点应在整个洁净区均匀布置。
(3)采样点一般布置在距离地面0.8-1.5m之间或操作平台的高度。
(4)尽量避免在尘粒较集中的回风口附近采样,而且采样人员应站在采样口的下风侧,应尽量少走动。
Ø 可接受标准:
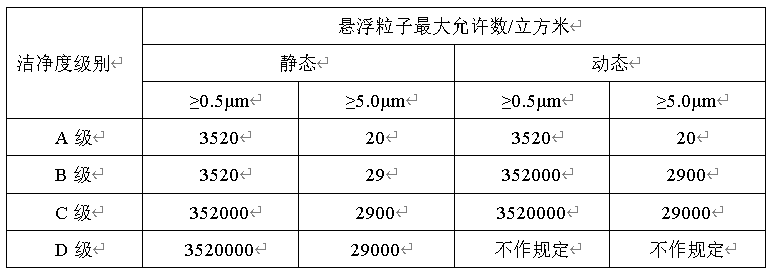
Ø 更换高效过滤器后应对悬浮粒子进行测试。
3.5微生物
(1)微生物监测方法包括沉降菌法、定量空气浮游菌采样法和表面取样法(如接触碟法和擦拭法)。在无菌生产过程中,应当对微生物进行动态监测,评估无菌生产的微生物状况。
(2)各洁净级别环境微生物监测的可接受标准为:

(3)经采样后的培养皿应置于温度为30-35℃的恒温培养箱中培养3-5天。
3.5.1沉降菌
Ø 测试方法:
(1)采用自然沉降法收集空气中的生物粒子于φ90*15mm规格的TSA(胰酪胨大豆琼脂培养基)或营养琼脂培养基。
(2)每个培养皿暴露时间不得超过4小时;静态测试时,暴露时间不得少于半小时。
(3)具体采样方法参照《医药工业洁净室(区)沉降菌的测试方法》现行国家标准中的有关方法进行测试。
Ø 采样点:
(1)采样点一般布置在距离地面0.8-1.5m之间或操作平台的高度。
(2)尽量避免在尘粒较集中的回风口附近采样,而且采样人员应站在采样口的下风侧,应尽量少走动。
3.5.2浮游菌
Ø 测试方法:
(1)可采用在线监测系统进行动态在线采样监测,或采用德国默克公司MAS-100NT狭缝式浮游菌采样器等进行离线采样监测。
(2)采样用培养基为φ90*15mm或φ75*15mm规格的TSA(胰酪胨大豆琼脂培养基)或营养琼脂培养基。
(3)具体采样方法参照《医药工业洁净室(区)浮游菌的测试方法》现行国家标准中的有关方法进行测试。
Ø 采样点:
(1)除受洁净区的设备限制外,取样点应在整个洁净区均匀布置。
(2)取样点一般布置在距离地面0.8-1.5m之间或操作平台的高度。
(3)应根据被测区域的浮游菌控制限度和取样方式确定取样量,每个点一般采样一次。
(4)尽量避免在回风口附近采样,而且测试人员应站在取样口的下风侧。
3.5.3表面微生物
Ø 测试方法:
(1)采用接触碟(TSA)法或擦拭法来进行表面微生物的采样。接触碟的接触时间不得小于5秒。
(2)表面微生物的每点取样面积控制在大于25c㎡左右。
(3)动态采样时,对表面和操作人员的监测,应当在关键操作完成后进行。
(4)采样后需对表面进行清洁。
Ø 采样点:表面微生物监测的取样点数应依下列因素确定:
(1)洁净区的大小
(2)设备、管路等的复杂程度
(3)生产活动的重要性
(4)易受污染的部位等
4.监测频率
4.1生产用洁净区

5.异常情况处理
5.1洁净区悬浮粒子和微生物按照可接受标准的50%为警戒限、80%为纠偏限。
5.2当超出警戒和纠偏限度时,可以采用以下方法:
Ø 通知相关部门负责人;
Ø 经过调查判断超标的原因和导致的结果;
Ø 根据实际情况制定相应的纠正措施并执行以解决问题;
Ø 后续的回顾评价纠偏措施的有效性;
Ø 其他
5.3常见异常情况处理
5.3.1 悬浮粒子超标的处理措施
5.3.1.1 当洁净区悬浮粒子检测数据超过警戒限度时,加强对该区域的清场清洁工作以及增加悬浮粒子的检测频次。
5.3.1.2当洁净区悬浮粒子检测数据超过纠偏限度时,应重新对整个洁净区进行清洁工作,完成后重新检测,如仍不合格,应对高效过滤器进行份风量、换气次数以及泄漏等检查。
5.3.2微生物超标的处理措施
5.3.2.1当洁净区微生物检测数据超过警戒限度时,应加强对该区域的清场清洁工作。
5.3.2.2当洁净区微生物检测数据超过纠偏限度时,应首先对该区域进行清洁消毒工作;回顾检查清场记录,并对清洁和消毒方法进行评估;重新检测该区域的微生物,如微生物不合格,按悬浮粒子纠正措施解决。
6.数据分析
在日常的环境监测中,应及时分析环境监测数据,是否监测合格或出现倾向性数据,以评估洁净室(区)环境是否受控,评估警戒限和纠偏限是否适合及所采取的纠偏措施是否恰当。
如果出现连续超过纠偏限和警戒限、关键区域内发现有污染微生物存在、空气净化系统进行任何重大的维修、消毒规程改变、设备有重大维修或增加、洁净室(内)结构或区域分布有重大变动、引起微生物污染的事故、日常操作记录反映出倾向性的数据时,应重新评估监测程序的合理性。
<END>






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论