



2022年3月29日,信达生物递交的达伯坦®(佩米替尼片,pemigatinib)获得中国国家药品监督管理总局(NMPA)批准,用于治疗既往至少接受过一种系统性治疗,且经检测确认存在有成纤维生长因子受体(FGFR)2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者。
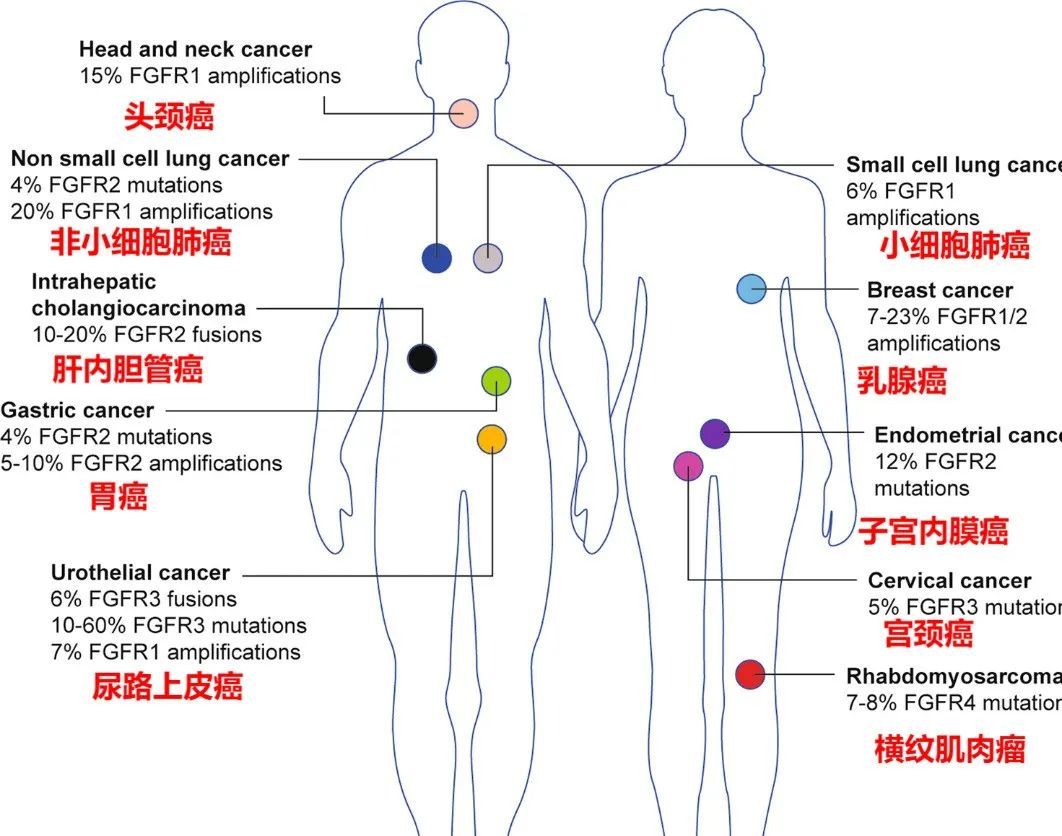
具有FGFR改变的癌症类型
胆管癌是一种致死率高的恶性肿瘤,手术是根治的唯一治疗手段,但由于其非特异性临床表现,大部分病人初次就诊时,常因伴有局部侵犯或远处转移而失去手术根治机会。既往十几年的治疗历程中,晚期胆管癌的系统治疗少有进展,化疗是主要治疗手段,但是疗效不佳。中国胆管癌患者存在巨大未满足的治疗需求。FGFR基因变异存在于多种类型的人类肿瘤中,主要通过FGFR基因扩增、突变、染色体易位以及配体依赖性活化引起的FGFR信号异常。成纤维细胞生长因子受体信号通过促进肿瘤细胞增殖、存活、迁移和血管生成来促进恶性肿瘤的发展。
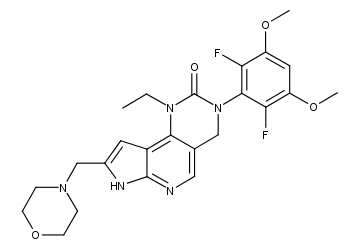
pemigatinib结构式
pemigatinib是一种针对FGFR亚型1/2/3的强效选择性口服抑制剂。2020年4月美国食品药品监督管理局(FDA)批准Incyte公司Pemazyre™(pemigatinib)用于治疗既往接受过治疗的成人晚期/转移性或不可切除的FGFR2基因融合/重排型胆管癌(通过FDA批准的检测方法确认)。2018年12月,信达生物与Incyte就pemigatinib等三个Incyte发现并研发的处于临床试验阶段候选药物达成战略合作。根据协议条款,信达生物拥有pemigatinib在中国大陆、香港、澳门和台湾地区的开发和商业化权利。相关专利:WO-2014007951。
pemigatinib药物基本信息
截图来源:药融云全球药物研发数据库
全球注册临床研究提示,对于FGFR2融合/重排的经治胆管癌患者客观缓解率(ORR)为37.0%,中位无进展生存期(mPFS)为7.0个月,中位总生存期(mOS)为17.5个月,对有应答的人群,中位生存甚至达到了30.1个月(数据截止日期:2020年4月7日)。中国桥接试验中FGFR2融合/重排经治胆管癌患者接受pemigatinib治疗ORR达到50%,中位无进展生存期达到6.3个月(数据截止日期:2021年1月29日)。
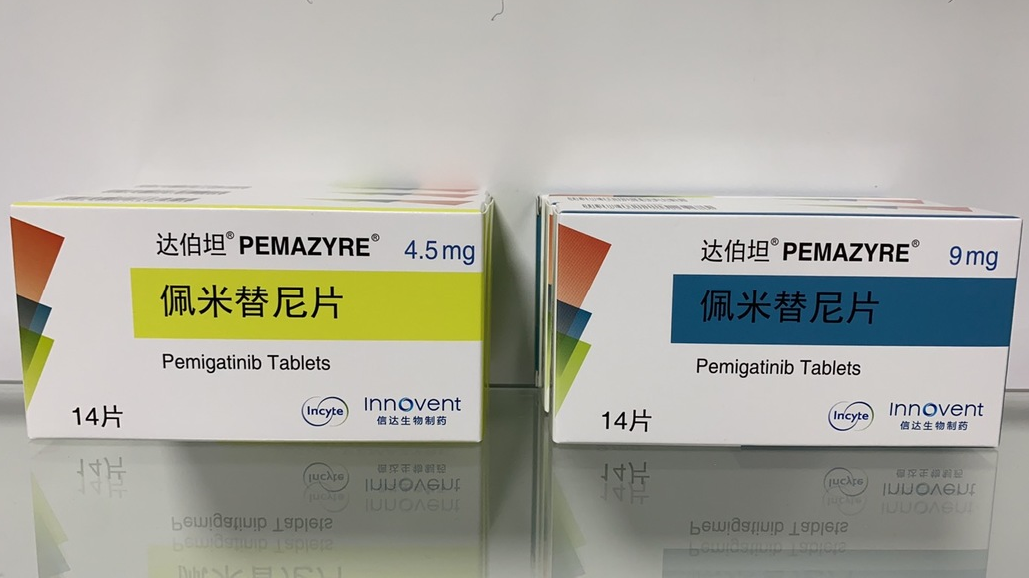
【商品名】:达伯坦®
【通用名】:佩米替尼片(Pemigatinib Tablets)
【规 格】:4.5mg*14片*1板/盒; 9mg*14片*1板/盒
【价 格】:24647元/盒;41900元/盒
参考:
NMPA/CDE;
药融云数据库,www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露;
www.innoventbio.com;
G-M. Shi , et al. ASCO 2022. e16183;
信达生物达伯坦®(佩米替尼)被纳入北京、山西、内蒙、青岛多地惠民保;等等。
想要解锁更多药物信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、申报情况、审批情况、最新进展、市场竞争格局、销售情况、市场规模与前景,可否投入仿制与研发!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论