
根据药融云数据统计,2022.07.25-2022.07.31期间,全球医药大健康行业共发生投融资事件 55起,较上周数量增加2起,其中创新药类融资共14起,较上周减少2起,但热度仍是最高;化学药类融资5起,靶向药4起,新型冠状病毒2起,仿制药1起。
而国内医药大健康行业共发生投融资事件22起,较上周数量减少3起,其中创新药类为8起,较上周减少1起,热度最高,可见创新药领域仍是投融资重点。在创新药大类中,抗癌药物研发、疫苗药物研发等为热门赛道。
国内融资事件数量、分类趋势(2022.5.30-2022.7.24)
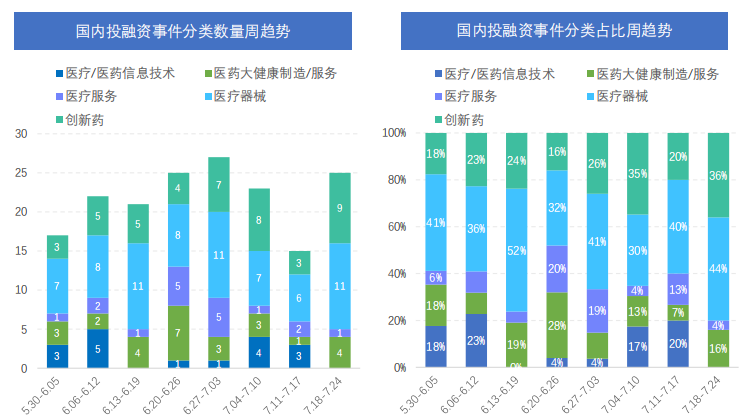
从已公布的融资金额来看,像益方生物、百迈生物、瑞博生物和盛睿泽华等企业融资金额均在数千万人民币以上,其中益方生物IPO融资19.82亿人民币,位居榜首。从融资轮次来看,本月创新药大类涉及企业融资轮次较为靠前,A轮及更早轮次投融资事件数量占比达到60%以上。
国内医药行业创新药投融资企业(2022.07.25-2022.07.31)
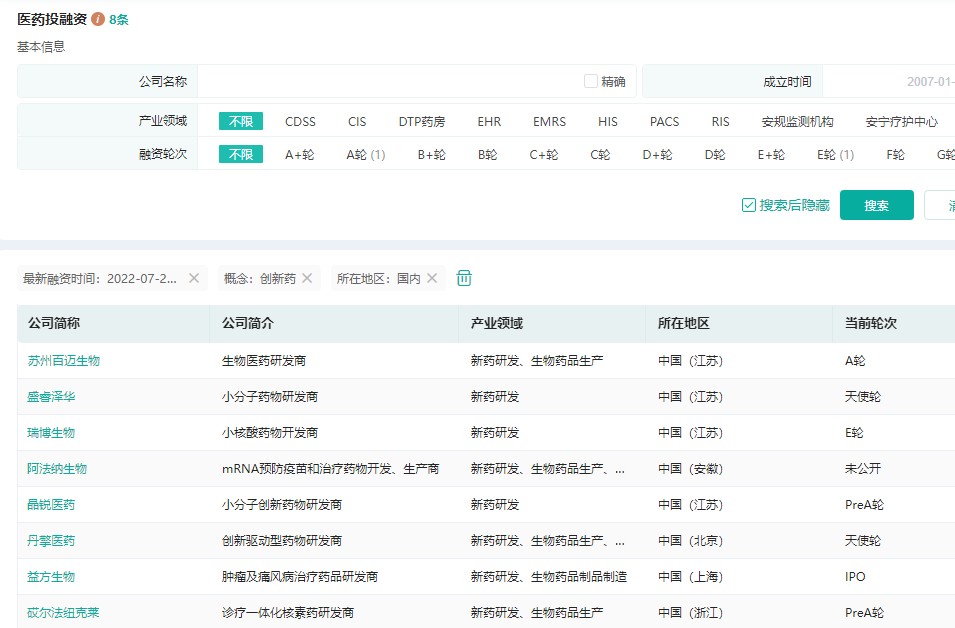
图片来源:药融云医药投融资数据库
一、益方生物
益方生物成立于2013年,2022年7月25日,益方生物正式在上海证券交易所科创板上市。益方生物的产品主要聚焦于肿瘤、代谢性疾病等重大疾病领域,坚持研制全球首创(first-in-class)和最优(best-in-class)的创新新药。截至2022年 6月23日,其产品管线有3个处于临床试验阶段的核心产品和5个临床前在研项目,3个核心产品均已获准开展II期或III期临床试验。
- 1.EGFR抑制剂甲磺酸贝福替尼
第三代EGFR抑制剂——甲磺酸贝福替尼(BPI-D0316),是一款针对治疗非小细胞肺癌(NSCLC)的靶向药,通过内源性配体竞争性结合EGFR,抑制酪氨酸激酶的活化,阻断EGFR信号通路,抑制肿瘤细胞增殖、转移,促进其凋亡。
2018年12月,贝达药业与益方生物达成合作,在合作区域(包括中国大陆、香港、台湾地区)内进行研发和商业化;并独家拥有在合作区域研发、制造和商业化贝福替尼的权利。2021年3月,贝福替尼上市申请获受理;4月,贝福替尼二线临床研究数据在第112届美国癌症研究协会(AACR)年会上亮相。
7月10日,国际著名肿瘤学期刊《胸部肿瘤学杂志》在线发表了甲磺酸贝福替尼单臂、多中心II期临床试验(IBIO-102)的研究结果。IBIO-102研究表明,贝福替尼在关键疗效指标方面取得了非常不错的结果。这一研究数据的发布将为贝福替尼在中国二线治疗适应症的获批奠定坚实的循证基础。
甲磺酸贝福替尼医药交易(贝达药业与益方生物)
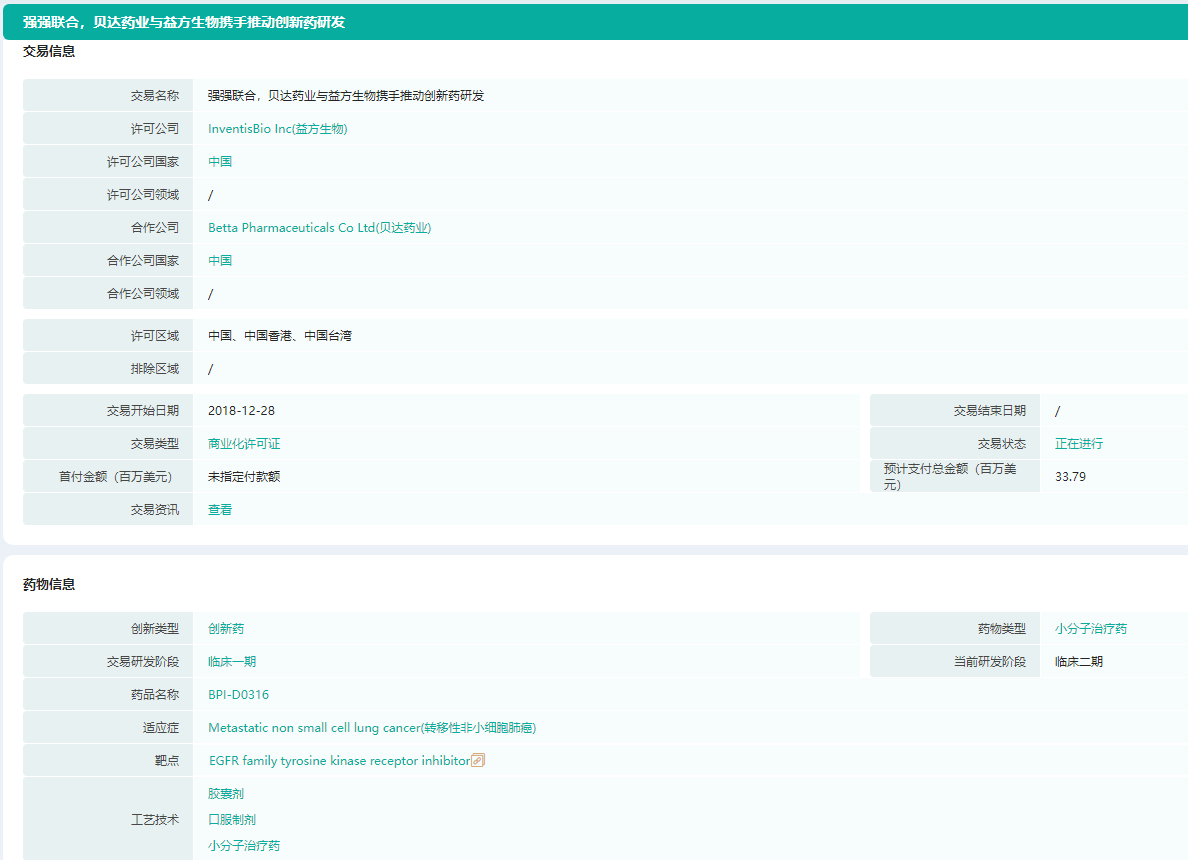
图片来源:药融云全球医药交易数据库
- 2.URAT1抑制剂D-0120
URAT1抑制剂D-0120是益方生物自主研发的一款尿酸盐转运体1(URAT1)抑制剂,用于治疗高尿酸血症及痛风。目前,D-0120已在中国和美国进行了多个临床试验,其中在中国的临床试验已进入2期开发阶段。尿酸是嘌呤代谢的产物,其水平升高会导致高尿酸血症,而尿酸在人体内的代谢水平与肾脏尿酸盐重吸收转运蛋白有关。URAT1抑制剂可以通过抑制尿酸盐的重吸收,从而促进尿酸从体内的排泄并降低血尿酸水平。
目前在全球范围内获批使用的URAT1抑制剂主要包括苯溴马隆、丙磺舒和雷西纳德。苯溴马隆在美国未获FDA批准上市,在欧洲上市后因肝脏毒性被撤市;丙磺舒在患者服用初期会显著肾脏中尿酸含量,增加肾结石和其他肾脏疾病的风险;雷西纳德2015年FDA获批上市后由于肾脏毒性被黑框警告,并于2019年撤市。
而D-0120与已上市直接竞品的技术差异主要体现在药物分子或先导化合物不同,D-0120作为新型的URAT1抑制剂产品,临床数据显示了良好的安全性和较强的降尿酸效果,其中D-0120的细胞内活性URAT1的IC50是同类URAT1抑制剂雷西纳德的50-100倍,而且具有更好的选择性,是一种更高效、安全的痛风治疗方案。
D-0120药物研发状态
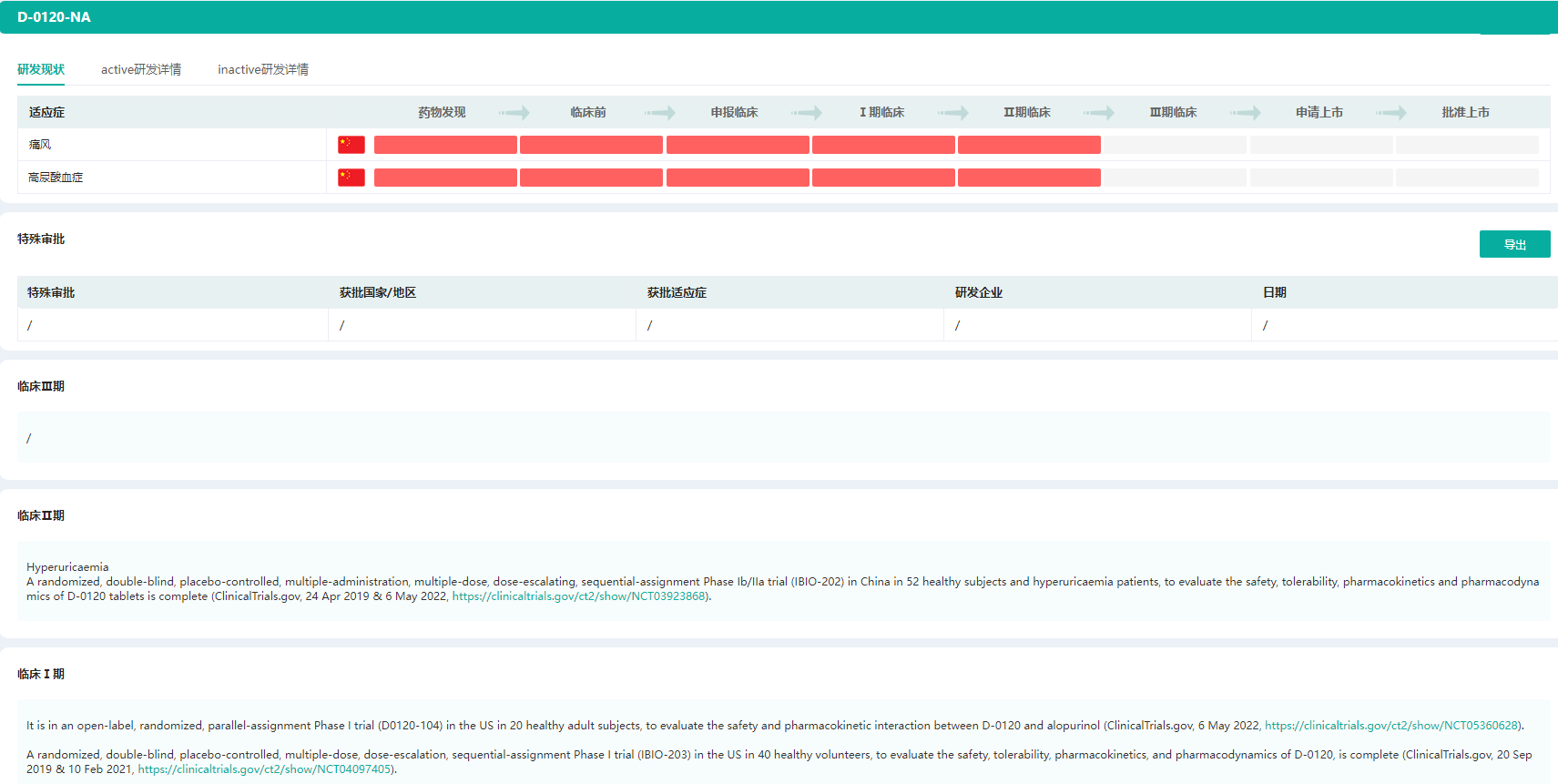
图片来源:药融云全球药物研发数据库
- 3.雌激素受体降解剂D-0502
雌激素受体降解剂D-0502是一款口服选择性雌激素受体降解剂(SERD),用于治疗雌激素受体(ER)阳性、人表皮生长因子受体2(HER2)阴性的乳腺癌。SERD可以与雌激素竞争结合雌激素受体(ER),一方面通过阻止ER二聚体阻断和靶基因ERE结合;另一方面SERD和ER结合形成的不同的二聚体构象,从而被细胞内蛋白降解系统的泛素酶识别,加速ER蛋白的降解,降低了细胞内ER的浓度。
目前唯一获批上市的SERD 靶向药氟维司群(Fulvestrant)需肌肉注射,2019年全球销售额约9亿美元(约61.5亿人民币)。
D-0502与氟维司群的技术差异主要体现在产品剂型和生物利用度方面,D-0502采用口服给药,便捷性和依从性更好;临床前研究和临床试验显示,D-0502 生物利用度较高,对雌激素依赖的肿瘤细胞增殖的抑制活性(IC50)和人体内的暴露量(AUC)均高于氟维司群。
D-0502药物基本信息/ATC信息
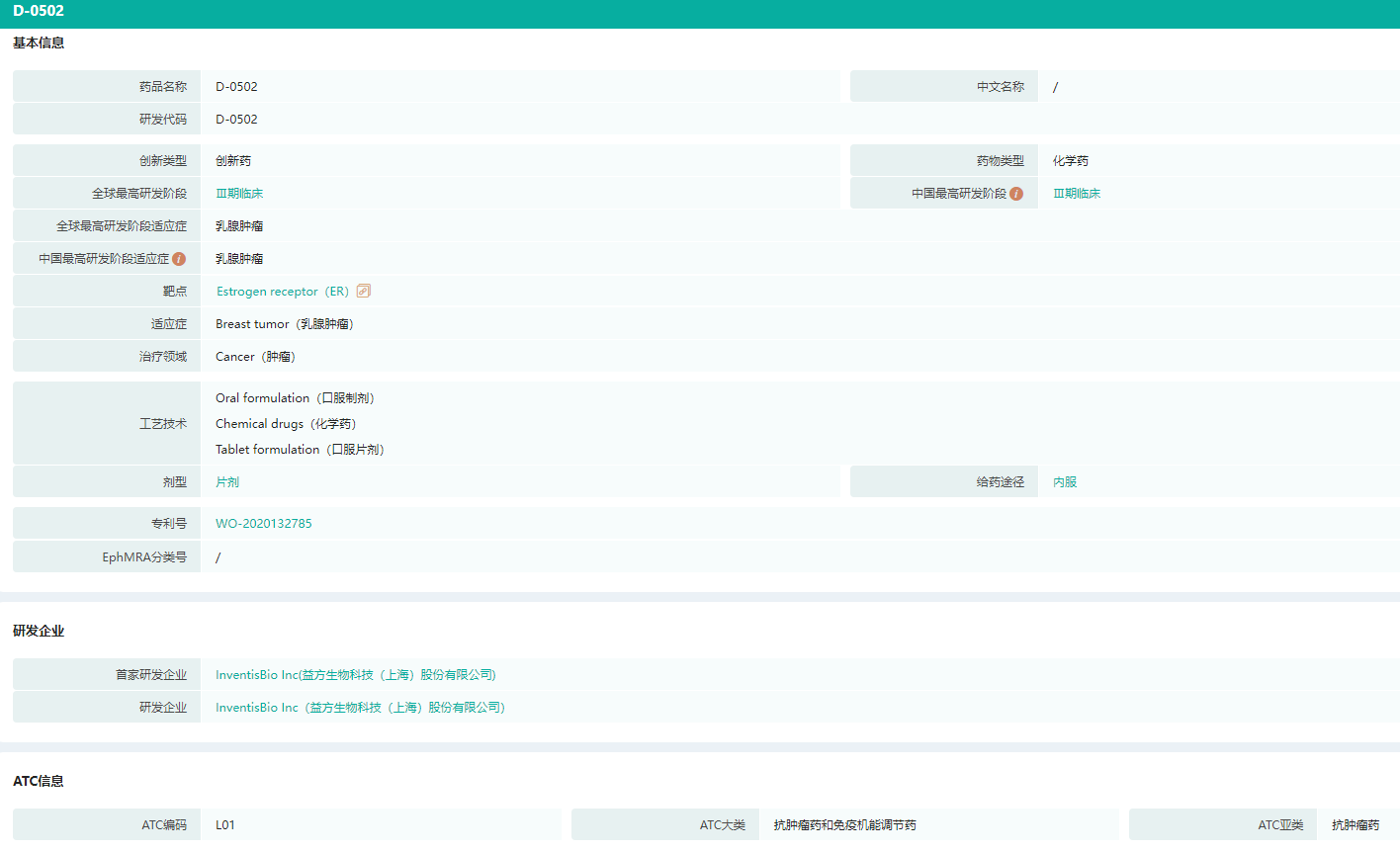
图片来源:药融云全球药物研发数据库
目前D-0502正在中国和美国同步开展国际多中心临床试验,并已于2021年10月获得CDE同意开展在ER阳性HER2阴性乳腺癌病人中与标准治疗进行头对头的注册性III期临床试验。
- 4.KRAS G12C抑制剂D-1553
D-1553是一款KRAS G12C抑制剂,用于治疗带有KRAS G12C突变的非小细胞肺癌、结直肠癌等多种癌症。D-1553是国内首个自主研发并进入临床试验阶段的KRAS G12C 抑制剂,已经在美国、澳大利亚、中国、韩国、中国台湾等国家及地区启动了国际多中心I/II 期临床试验,并已于2021年11月进入临床II期试验阶段。
2022年6月10日CDE公示益方生物的抗肿瘤药D-1553已被纳入突破性治疗药物。这是中国针对 KRAS G12C突变的自主创新药首次被纳入突破性治疗药物。
D-1553审评概况
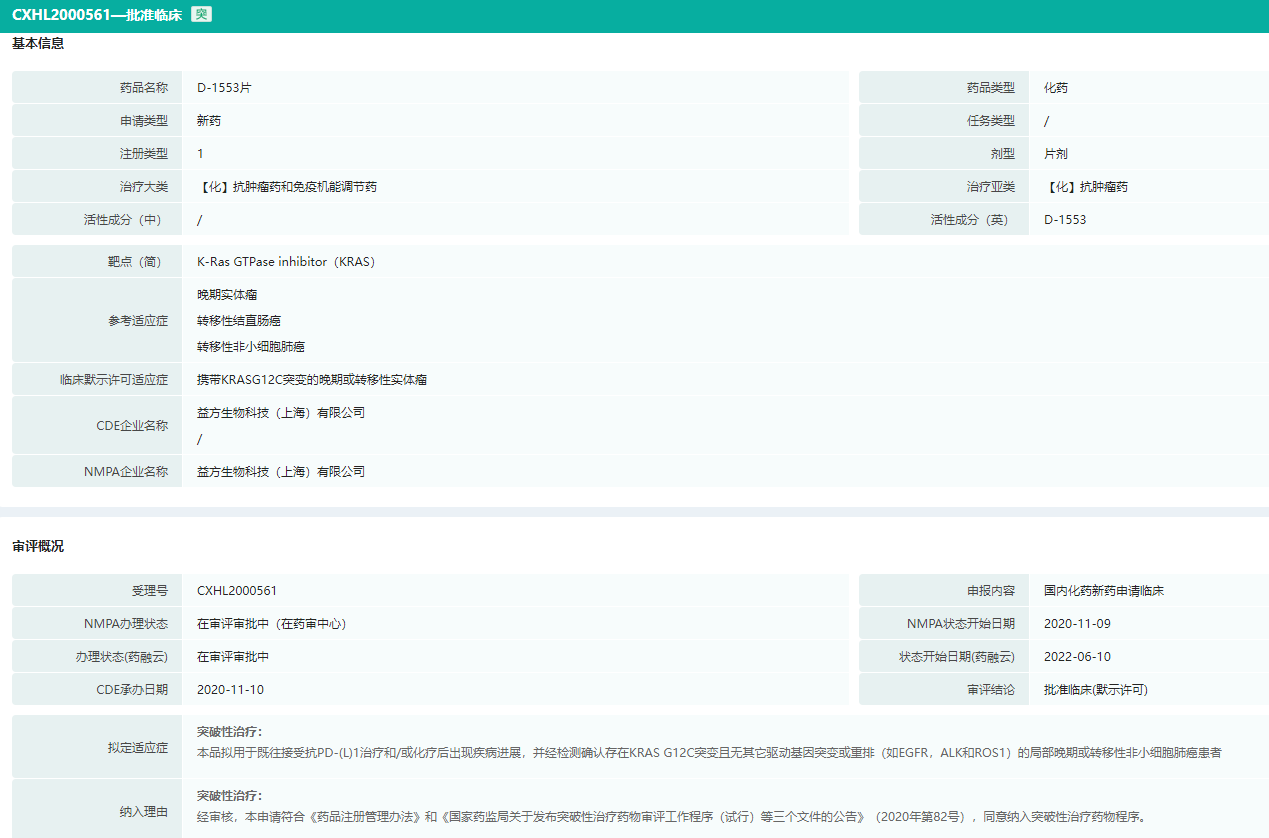
图片来源:药融云中国药品审评数据库
此外,益方生物还持续开发包括针对激酶、肿瘤驱动基因、肿瘤免疫、合成致死通路等一系列临床候选化合物,包括治疗自身免疫疾病的激酶抑制剂,用于多种实体肿瘤的肿瘤驱动基因抑制剂、肿瘤免疫调节剂、合成致死抑制剂等。
益方生物的三款核心在研产品市场空间大、产品成药性高、临床进展领先。但是尽管如此,在相同赛道益方生物也将面临越来越多的竞争对手,目前仅国内进入临床阶段的URAT1抑制剂在研管线就有9个,口服SERD 6个,KRAS G12C抑制剂4个,其中不乏恒瑞、阿斯利康、礼来、诺华、罗氏这样的国内外巨头,竞争十分激烈。
二、瑞博生物
瑞博生物,成立于2007年,专注于小核酸创新技术和小核酸药物研究开发。2020年12月29日,瑞博生物科创板招股书正式公开,被誉为国内“小核酸药物第一股”。瑞博生物公司持续发展收获了众多投资者的青睐,目前已完成四轮超过13亿元的股权融资,资方名单中不乏高瓴、中金等顶级资本,投后估值超30亿元。
对于创新型生物技术公司,技术平台是基础中的基础,是公司的核心竞争力。专注于小核酸药物开发的公司,技术平台的着眼点通常在小核酸序列的发现、分子的修饰以及体内递送系统这3个核心的步骤。据悉,瑞博生物目前已经建立了包含上述3个技术环节的、可覆盖小核酸药物全生命周期的研发平台。
目前,瑞博开发出了12条研发管线,治疗领域涉及心血管和代谢性疾病、肝病、眼科疾病、罕见病及其他,已经开展临床试验的有SR061、SR062和SR063,均为引进的项目,其中SR061从夸克公司引进(以合资公司的形式),SR062和SR063从Ionis公司引进。其余项目除SR060已经由Band公司在奥地利开展1期临床试验之外,均处于临床前阶段,有自主研发,也有合作开发。
瑞博生物产品研发管线
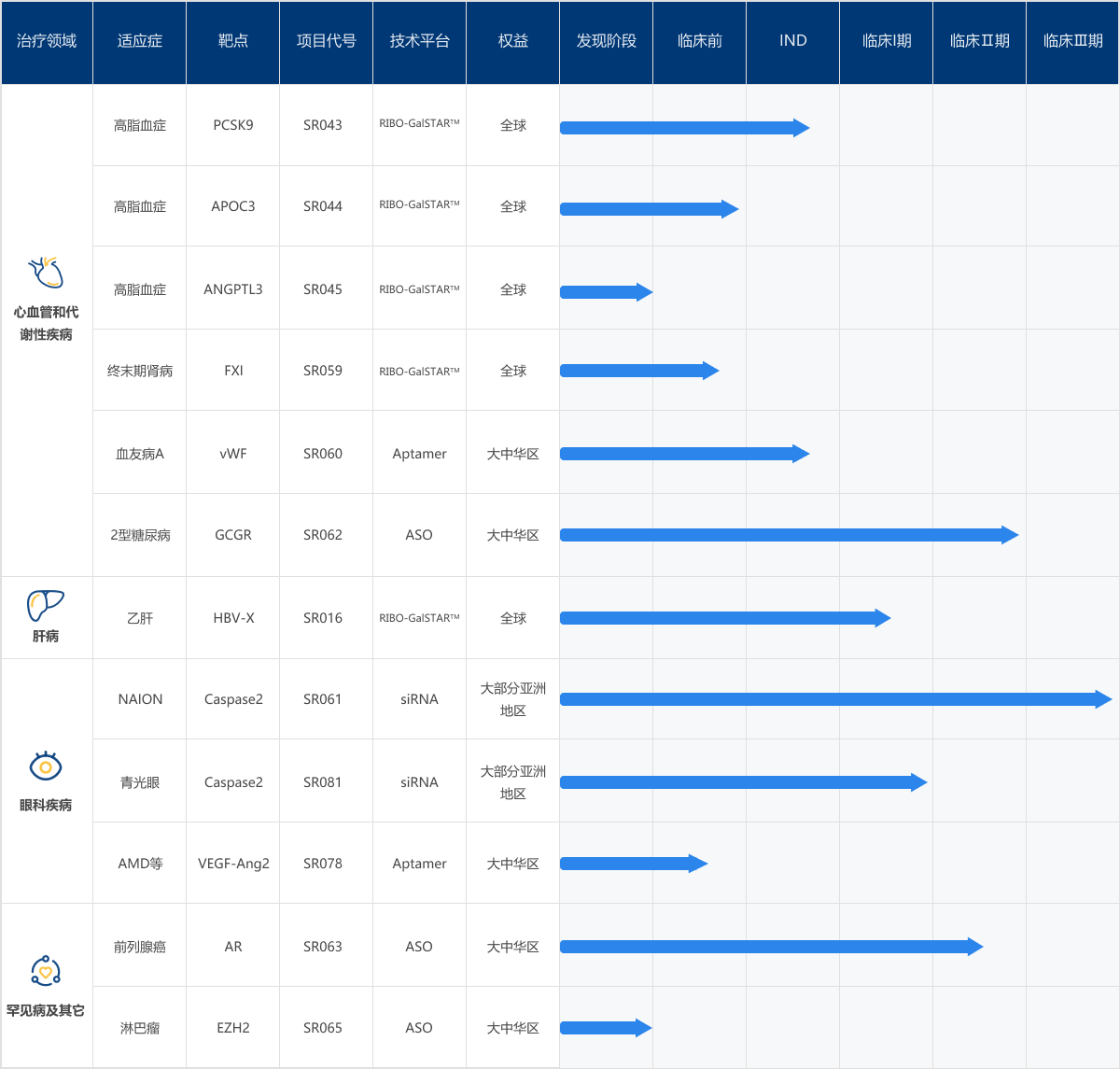
图片来源:瑞博生物官网
- 1.SR061(QPI-1007/cosdosiran)
瑞博生物的SR061(QPI-1007/cosdosiran)是一种靶向Caspases 2视神经保护的siRNA 药物,于2012年从夸克公司引进,通过 RNAi 抑制靶基因的表达,阻止视网膜神经节细胞(RGC)凋亡和继发的神经轴突退化,从而防止视力和视野进一步恶化,达到保护视力的治疗效果。
据药融云数据统计,SR061(QPI-1007/cosdosiran)目前在全球已完成 1个临床 I 期研究和 1 个Ⅱ/Ⅲ 期国际多中心临床研究(其中包括 34 例中国受试者),临床试验数据分析结果支持针对具有极大未满足临床需求的 NAION 亚组患者人群开展III期确证性临床研究,IND 申请正在准备中。
- 2.SR062
SR062是一款反义寡核苷酸(ASO)新药,特异性地靶向作用于胰高血糖素受体(GCGR)的 mRNA,通过阻止肝糖原转化和促进GLP-1水平升高的双重作用机制发挥降糖作用,用于治疗2型糖尿病。SR062由Ionis开发,并将其中国区(包括香港、澳门)权益授予给公司。
SR062基本信息(部分)
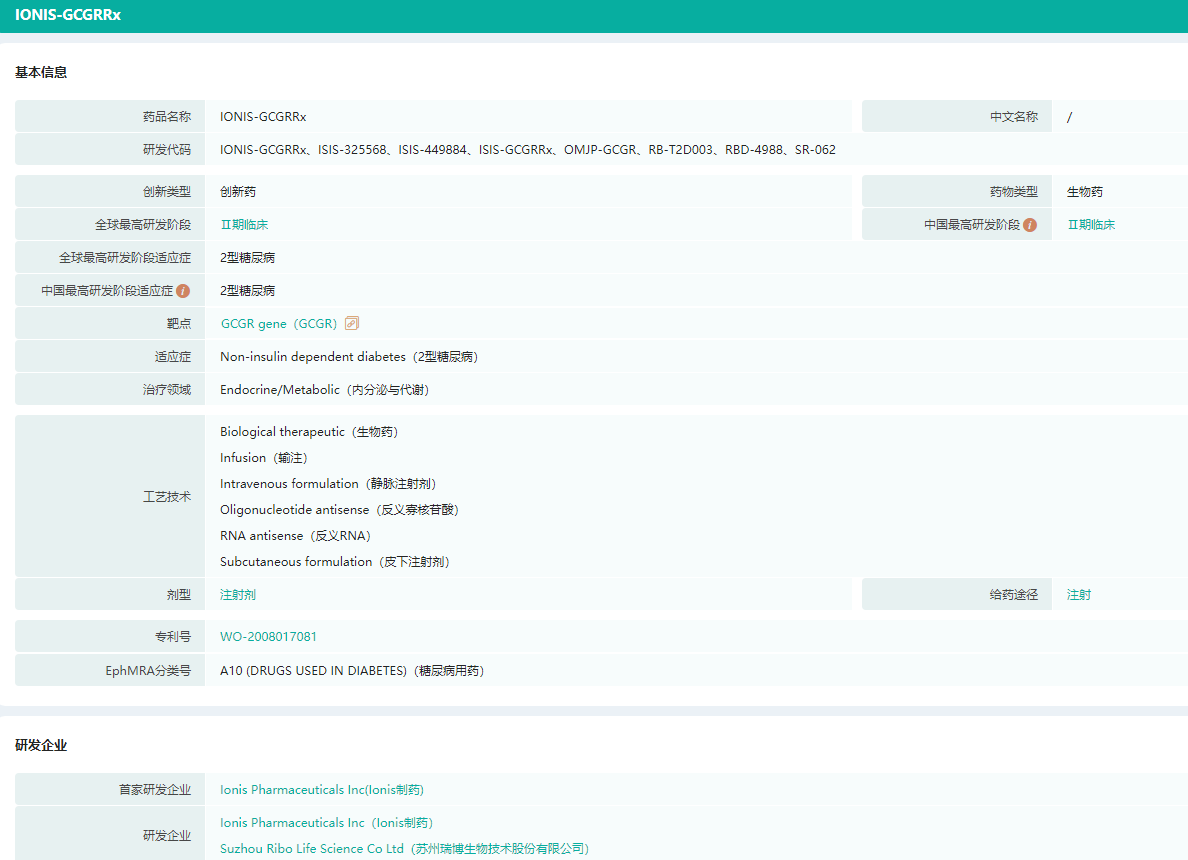
图片来源:药融云全球药物研发数据库
SR062相比国内常见的胰岛素、GLP类药物,在临床以及非临床的表现中展现了三个明显的特点:长效、降糖机制强大、安全性更强。国外已完成的临床研究显示,SR062在给药结束后4周甚至更长时间内仍能观察到良好的控制血糖效果,SR062有望实现每两周一次甚至更长的给药周期。
SR062 具有独特的双重降糖机制。在非临床研究中,SR062 在其它药物治疗失败的情况下亦能减少胰岛素抵抗的肝糖输出,改善胰岛素分泌,显示 SR062 有望在多数药物治疗失败后仍可能发挥作用。
- 3.SR063
SR063靶点为GCGR,用于治疗雄激素受体剪接变异体7(AR-V7)阳性的转移性去势抵抗性前列腺癌(mCRPC)患者,也是首款治疗AR-V7阳性前列腺癌患者产品,国内目前正在开展II期临床研究。
目前,全球已上市的14款药物中,86%用于治疗罕见的遗传性疾病,其中9款为ASO、4款为siRNA、1款为适配体。国内小核酸药企业都还处于发展初期或者上升期,目前有14款小核酸药物研发进入临床研究阶段。其中6款药物为ASO药物,7款为基于RNAi的siRNA小核酸药物,1款为基于CRISPR/Cas9的sgRNA药物。涉及企业主要有圣诺医药/香雪制药、瑞博生物、海昶生物、中美瑞康等。小核酸赛道快速兴起,国内首款即将到来。
想要了解更多全球医药行业投融资事件吗?欢迎关注“药融云”公众号(gh_d20f87bd52d9),回复关键词“报告”即可领取每周的《药融云医药行业观察周报》以及医药行业药物报告。
<END>






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论