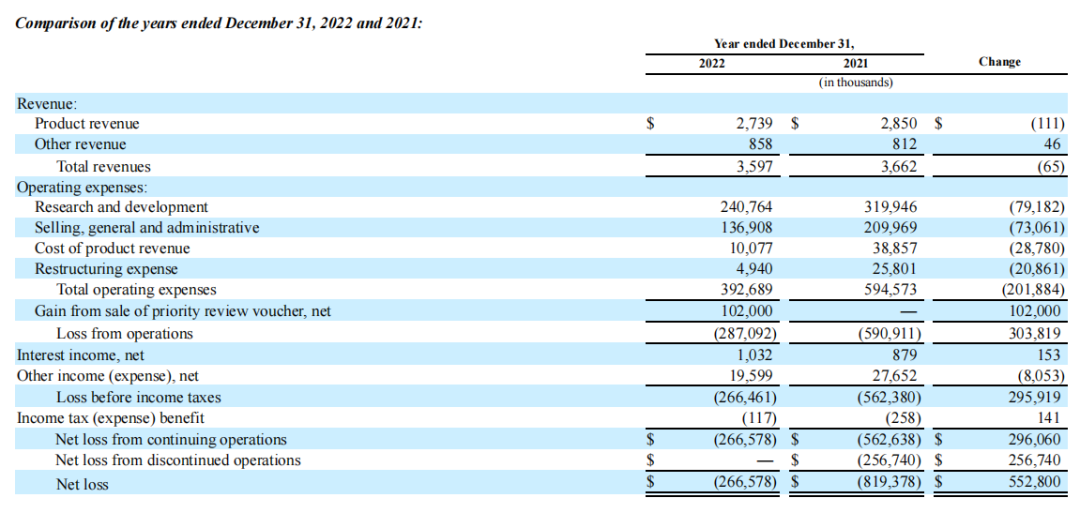
3月29日,蓝鸟生物2022年业绩报告公布:2022年营收360万美元,这主要得益于2项获得FDA批准的基因疗法ZYNTEGLO和SKYSONA。2022年蓝鸟生物研发支出为2.41亿美元;截至2022年12月31日,公司的现金和现金等价物、有价证券和受限制的现金余额约为2.27亿美元。
截止目前,蓝鸟生物已有2款基因疗法获批上市,而第三款基因疗法lovotibeglogene autotemcel(lovo-cel)用于治疗镰状细胞病,本来预计本周五前向FDA提交生物制品许可申请(BLA),但是现在该日期推迟了几周。

蓝鸟生物首席执行官Andrew Obenshain
蓝鸟生物首席执行官Andrew Obenshain说道:“原计划lovo-cel于2023年第一季度获得FDA批准,但是现在可能要错过这个时间了。”
受此影响,蓝鸟生物股价下跌31%。目前,蓝鸟生物市值为3.47亿美元。

01.lovo-cel BLA提交正在进行中
去年12月,蓝鸟生物在进行了产品可比性分析并向美国FDA提供数据后,FDA于2月给予反馈并提到一些问题,要求公司在提交BLA前做出回应。据药融云数据库显示,lovo-cel此前已获得了美国FDA认证的快速通道、孤儿药、罕见儿科疾病用药与再生医学先进疗法4种特殊审批,这或许会极大程度地加速FDA审批lovo-cel新药上市的时间。
截图来源:药融云全球药物研发数据库
蓝鸟生物计划对12岁及以上有血管闭塞史的患者进行优先审查。如果获得FDA批准,预计2024年初对lovo-cel进行商业化。
02.ZYNTEGLO®商业化势头持续发展
ZYNTEGLO®(betibelogene autotemcel,beti-cel)是一款β-地中海贫血基因疗法,也是蓝鸟生物公司商业化的第一款基因疗法。ZYNTEGLO最早于2019年在欧盟、挪威、冰岛、列支敦士登等4个国家陆续上市。2022年8月,获得FDA批准,进入美国市场。蓝鸟生物为其定价为280万。
截图来源:药融云全球药物研发数据库
蓝鸟生物在ZYNTEGLO的推出方面取得了重大进展,迄今为止,已有5例β-地中海贫血患者启动治疗(细胞收集)。随着商业化不断推进,蓝鸟生物计划扩大制造能力,以满足不断增长的市场需求。
平均而言,该疗法的事先授权仅需两周,这是付款人接受ZYNTEGLO的有力指标;迄今为止,付款人承保范围内的最终拒赔率一直为零。
蓝鸟生物的合格治疗中心(QTC)布局继续按计划扩展,有12个QTC已启动,还有大约30个QTC处于谈判阶段;到2023年底,公司仍有望扩大到40-50个OTC。
03.SKYSONA®商业化步入正轨
蓝鸟生物第2款基因疗法——SKYSONA®(elivaldogene autotemcel,eli-cel),最早于2021年7月面世,2022年9月在美国获批上市,主要用于减缓4-17岁早期活动性脑肾上腺脑白质营养不良(CALD)男孩神经功能障碍的进展。定价为300万美元。
两名接受SKYSONA治疗的患者的细胞收集工作已经完成,首次输注治疗也已完成。
自获批以来,蓝鸟生物已经启动了三个QTC来治疗脑肾上腺脑白质营养不良症(CALD)患者。
总而言之,2022年蓝鸟生物推出了两款重磅基因疗法,2023年它计划对第三种基因疗法lovo-cel进行商业化。蓝鸟生物预计2023年全年的现金消耗将在2.7亿~3亿美元。
参考资料:
[1] 药融云数据库
[2] https://investor.bluebirdbio.com/news-releases/news-release-details/bluebird-bio-reports-fourth-quarter-and-full-year-2022-financial
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>





























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)










 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论