
无论是药物研发立项,还是后续的跟踪调查,医药相关人员对“数据”的需求始终在不断变化,各类复杂使用场景下的个性化数据需求也应运而生。
苟日新,日日新,又日新。因此,药融云团队始终在不断对药融云数据库进行打磨精进,力求为用户提供更加全面、准确、智能的生物医药全生命周期数据解决方案。
此次更新,我们对药品研发、全球上市两大数据库群下的2个子库进行了多方面的功能升级。以下是本次更新的详细内容。
药品研发
临床试验结果数据库
升级改版了数据库的结果展示方式,详细展示试验标题、试验药品、靶点、治疗领域、适应症、主要终点报告日期等不同维度信息,帮助您充分了解重要新药公开发表的临床结果数据,让研发设计更高效更精准。
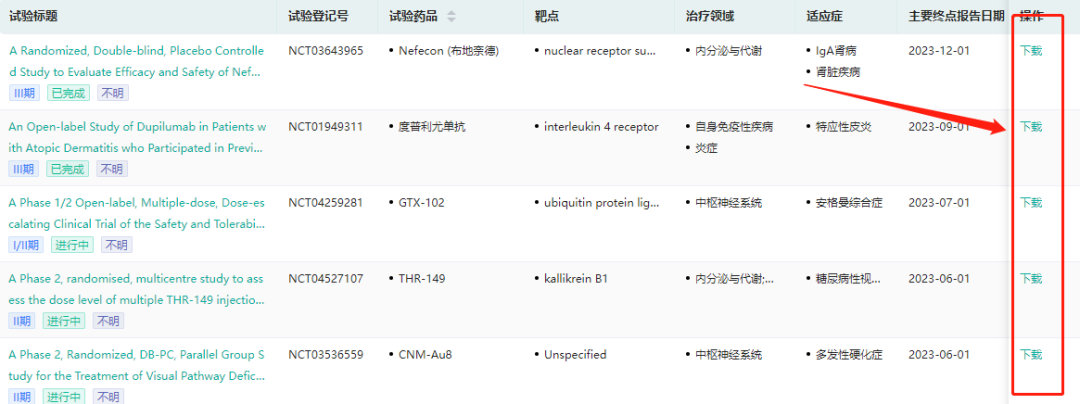
同时,还新增了临床试验结果报告下载功能,可以一键导出试验相关数据信息,大大提高工作和学习效率。数据库所有数据都来自于官方权威信息源,并且提供信息追溯,保证数据真实准确。
全球上市
中国药品批文数据库
新增多个搜索/筛选项
?新增「历史批文」检索框,勾选此复选框后,检索范围扩大至文号研发历程,方便您检索所有历史批文信息。勾选历史批文复选框后,可查询所有历史数据,列表页展示时间最新的那一条数据,进入详情页后,即可查看历史批文信息和文号研发进程。
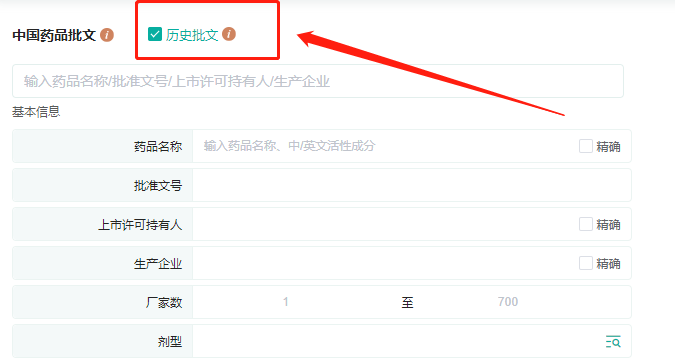
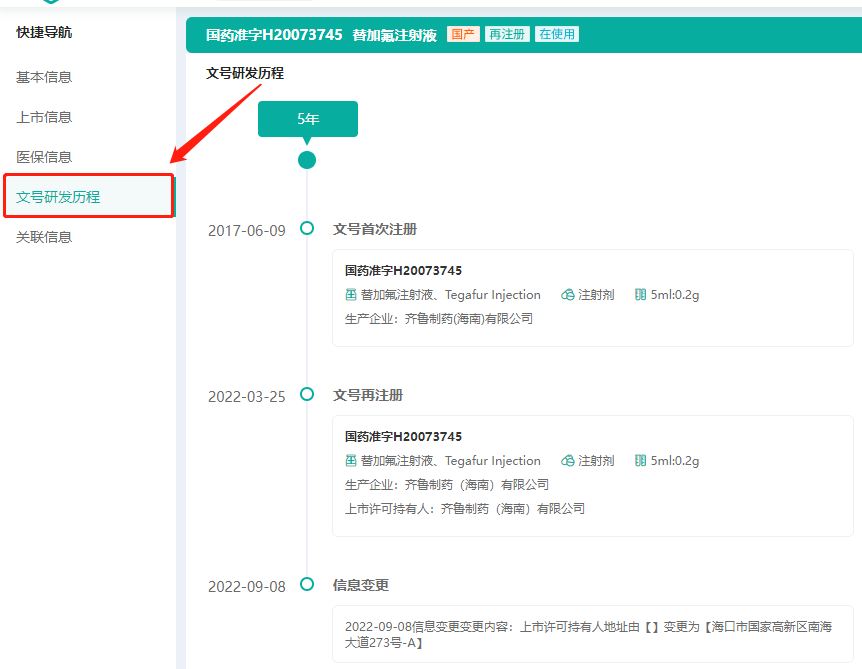
文号研发历程新增信息变更内容,批文变化更直观
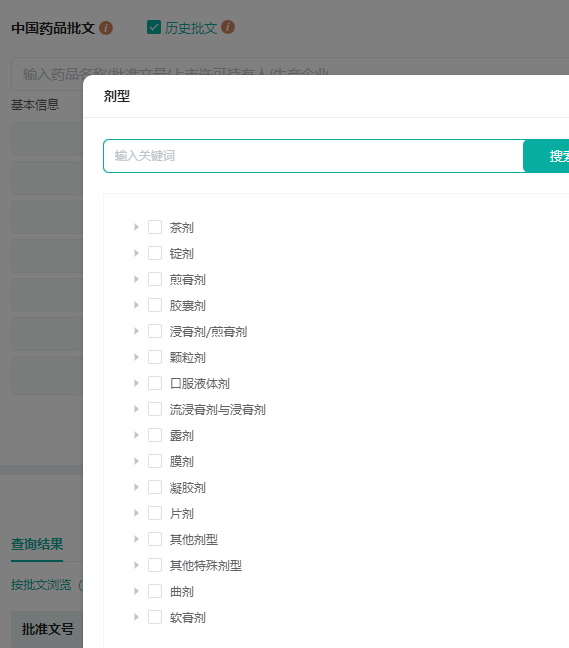
?新增「剂型」层级的筛选,同时可直接搜索剂型关键词,帮助精准筛选目标药品。
?新增「集采批次」筛选项,助您快速了解市场竞争态势,分析产品竞争力。
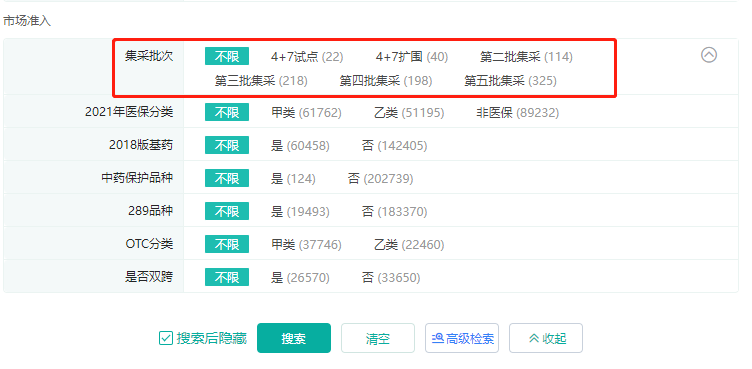
?新增说明书和审评文件链接,助您全面了解目标药品安全性和有效性,掌握技术审评报告相关信息。
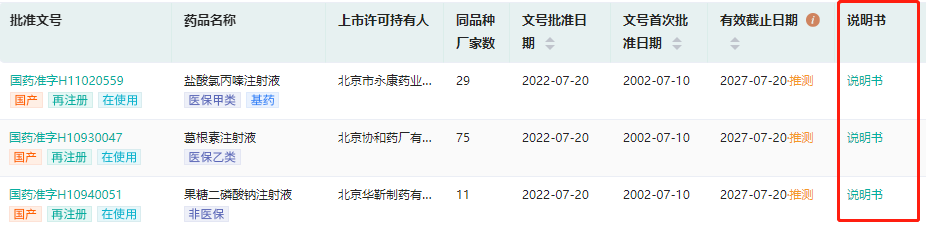
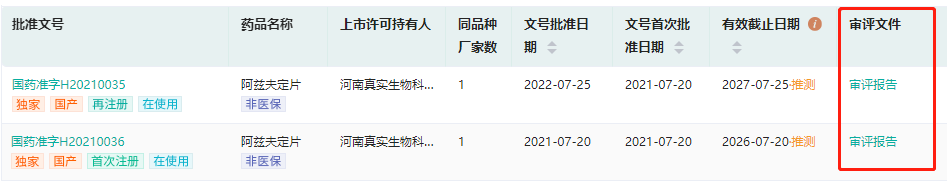
新增全局分析功能,升级数据分析呈现方式
在全局分析界面,可通过不同分析维度,掌握每年获批批文趋势,分析不同品种获批企业的竞争格局,洞悉企业自身、竞争对手或目标企业的产品结构、产品独特性和产品竞争力,助力企业战略规划与决策。
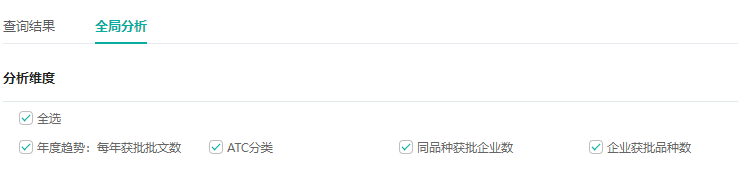
如筛选「糖尿病用药」的批文后,通过全局分析界面,可直观地了解到以下信息:
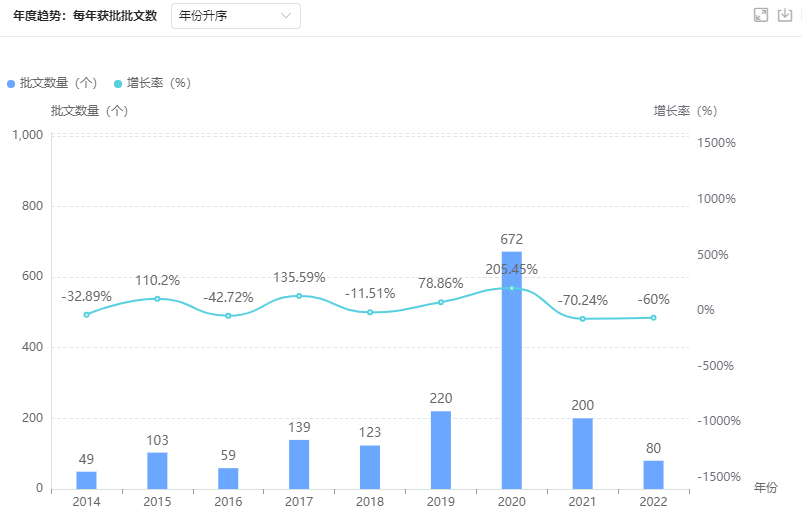
- 近年来2020年获得批文的糖尿病用药最多,超600品规
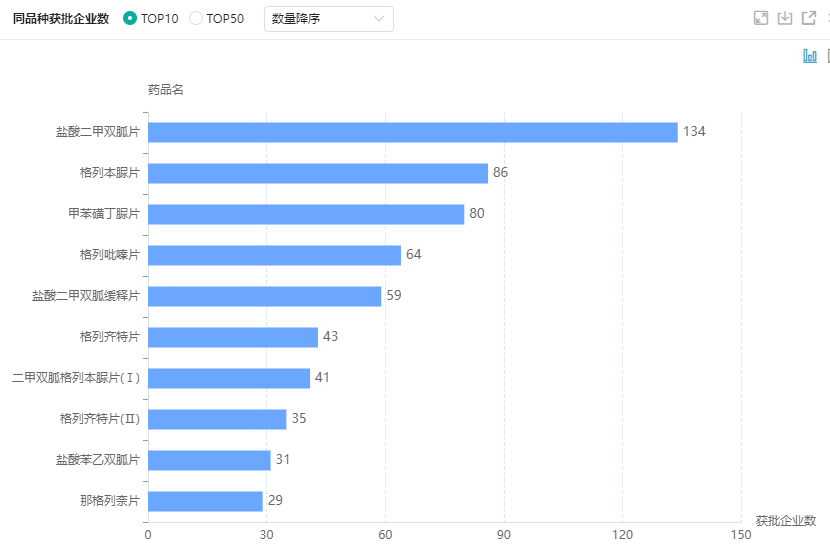
- 糖尿病用药中,盐酸二甲双胍片、格列本脲片、甲苯磺丁脲片等品种的市场竞争最为激烈
- 从企业来看,除诺和诺德外,江苏万邦、通化东宝、正大天晴、豪森等本土药企的糖尿病用药产品线最为丰富
还有更多的使用场景等待您去发现!
糖尿病用药批文获批趋势
糖尿病用药-同品种获批批文数TOP10
糖尿病用药-企业获批品种数TOP10

本次的更新小报就到这里,还没有使用权限的朋友,可进入药融云官网(vip.pharnexcloud.com/?zmt-mhwz),申请免费试用。
药融云团队不断打磨数据库,致力于为用户提供国内最权威的医药数据智能分析解决方案,也欢迎大家向我们提出关于数据库的宝贵意见!
—END—




























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)










 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论