
肝癌是最常见恶性肿瘤之一,据报道我国2022年肝癌新发病例达43.1万例,死亡41.2万例,由于乙肝感染率高、爱吃咸菜等生活习惯,我国肝癌发生率较高,相比之下,美国肝癌新发病例仅为4.4万例,死亡2.1万例。不论是中国还是美国,肝癌依旧是预后最差的几种恶性肿瘤之一,虽然经过了大量的科学研究,发现了大量的靶点、开发了多个潜在药物,但绝大部分都以失败告终,即便部分产品获批上市,但相比肺癌乳腺癌,客观缓解率较低,无进展生存期、总生存期延长较短,患者获益不够突出。
由于调控肝癌的信号传递通路极其复杂,鲜有单靶点的靶向制剂开发上市,目前肝癌靶向治疗药物获批上市的产品主要是多靶点的小分子靶向制剂和免疫检查点抑制剂。另外,由于近年来核酸药物的兴起,多个用作肝癌治疗的核酸药物已经处于早期研究阶段,但愿这些药物会带来质的突破。当然了,随着乙肝疫苗的不断普及,我国乙肝感染率已经大幅下降,未来肝癌的发病率也会逐渐降低。本文将会对国内肝癌靶向治疗药物进行一个大盘点,共罗列了15款药物。
一、抗血管生成治疗
01.索拉非尼(Sorafenib)
索拉非尼获批于2005年,截止目前获得适应症为肝细胞癌、肾细胞癌和分化型甲状腺癌。肝癌方面获批的用法为无法手术的肝细胞癌(HCC)治疗。本品是一种多靶点抑制剂,可同时作用于c-CRAF, BRAF、KIT、FLT-3、RET、RET/PTC, VEGFR1/2/3和 PDGFR-ß等多个靶点。在一项代号为SHARP的临床试验中,602名无法手术的HCC患者按(1:1)分别接受本品或安慰剂治疗,结果显示中位总生存期(mOS)分别为10.7个月 vs 7.9个月,mPFS分别为5.5个月 vs 2.8个月。
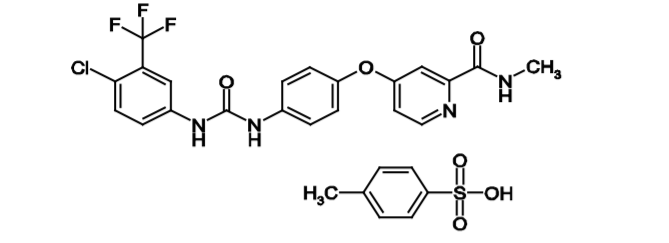
02.瑞戈非尼(Regorafenib)
瑞戈非尼于2012年获得FDA批准,可用于胃肠道间质肿瘤、直肠癌和肝细胞癌,肝细胞癌方面,本品获批的用法是既往接受过索拉非尼治疗的HCC治疗。本品是一种多靶点抑制剂,可以抑制RET, VEGFR1/2/3, KIT, PDGFR α/β, FGFR1/2, TIE2, DDR2, TrkA, Eph2A, RAF-1, BRAF, BRAF V600E, SAPK2, PTK5, Abl和CSF1R等多个靶点。在一项多中心的临床试验中,入组患者均为Child-Pugh分级A级、巴塞罗那分期(Barcelona Clinic Liver Cancer)分别为B期或C期、既往经历过索拉非尼治疗后进展的HCC患者(平均索拉非尼治疗时间为7.8个月)。受试者按2:1分组,分别接受本品或安慰剂治疗,结果显示mOS分别为10.6个月 vs 7.8个月,mPFS分别为3.1个月 vs 1.5个月,客观缓解率(ORR)分别为11% vs 4%。
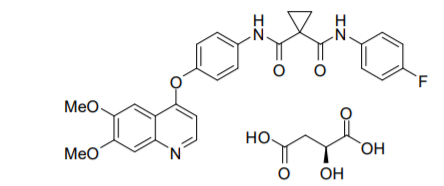
03.卡博替尼(Cabozantinib)
卡博替尼于2012年获得FDA批准用于分化型甲状腺癌治疗,随后又获得肾细胞癌、肝细胞癌的适应症。肝细胞癌方面,本品获批的用法是既往接受过索拉非尼治疗的HCC治疗。本品同样是一款多靶点抑制剂,可同时作用于MET, VEGFR1/2/3, AXL, RET, ROS1, TYRO3, MER, KIT, TRKB, FLT-3, 和TIE-2等靶点。疗效方面,在一项代号为CELESTIAL的临床试验中,入组患者均为Child-Pugh分级A级,既往接受过索拉非尼治疗的患者。707名受试者按2:1分组,分别接受本品或安慰剂治疗,结果显示mPFS分别为5.2个月 vs 1.9个月,mPFS分别为10.2个月 vs 8.0个月,ORR分别为4% vs 0.4%。
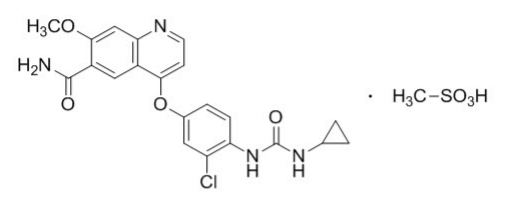
04.仑伐替尼(Lenvatinib)
仑伐替尼于2015年获得FDA批准上市,截止目前已经获得四个适应症,包括无法手术的肝细胞癌一线治疗。仑伐替尼是一种多靶点抑制剂,可同时抑制VERGF1/2/3、FGF1/2/3/4、PDGFRα、KIT和RET。在一项代号为REFLECT的临床试验中,954名既往未接受过治疗的转移性HCC患者加入了试验,入组患者均为既往未接受过全身性治疗、Child-Pugh分级A级、巴塞罗那分期(Barcelona Clinic Liver Cancer)分别为B期或C期。受试者按1:1的比例分组分别接受本品或索拉非尼治疗,结果显示中位总生存期(mOS)分别为13.6个月 vs 12.3个月,中位无进展生存期(mPFS)分别为7.3个月 vs 3.6个月,ORR分别为41% vs 16%。
05.多纳非尼(Donafenib)
多纳非尼于2022年获得NMPA批准上市,用于既往未接受过全身系统性治疗的不可切除性肝细胞癌治疗。本品为为索拉非尼的氘代化合物,在一项代号为ZGDH3的临研究中,668名既往未接受过全身系统治疗、且不可切除肝细胞癌患者按 1:1 随机分组,分别接受本品或索拉非尼治疗,所有入组患者BCLC 分期为C期,Child-Pugh分类为A级。结果显示本品和索拉非尼治疗组的mOS分别为12.1个月 vs 10.3个月,mPFS分别为3.7个月 vs 3.6个月,ORR分别为4.6% vs 2.7%。

06.雷莫芦单抗(Ramucirumab)
雷莫芦单抗是一种VEGFR2抑制剂,首次获批于2014年,补充新适应症于2022年获得FDA批准,用于既往接受过索拉非尼治疗,AFP≥400 ng/mL的肝细胞癌治疗。雷莫芦单抗是一种VEGFR抑制剂,在一项代号为REACH-2的临床试验中,292名Child-Pugh分级为A级、巴塞罗那分期分别为C期及B期不可切除或介入治疗的患者加入了试验,受试者按2:1分组,分别接受本品治疗或最佳支持性护理,mOS分别为8.5个月 vs 7.3个月,mPFS分别为2.8个月 vs 1.6个月,ORR分别为4.6% vs 1.1%。
07.阿帕替尼(apatinib)
阿帕替尼也是一种VEGFR2抑制剂,于2014年获得NMPA批准,适用于:1)既往至少接受过2 种系统化疗后进展或复发的晚期胃腺癌或胃- 食管结合部腺癌治疗,2)既往接受过至少一线系统性治疗后失败或不可耐受的晚期肝细胞癌治疗。在一项国内多中心的临床试验中,400名至少既往接受过1线系统性治疗失败的患者(2:1)随机接受本品或安慰剂治疗。结果显示mOS分别为8.7个月 vs 6.8个月,mPFS分别为4.5个月 vs 1.9个月,ORR分别为28% vs 2%。
08.贝伐珠单抗(Bevacizumab)
2004年,FDA批准了罗氏的VEGFR抑制剂贝伐珠单抗(bevacizumab)用于转移性直肠癌治疗,随后罗氏又通过补充申请,获得了胃癌相关的适应症——与阿替利珠单抗联用,一线治疗转移性肝细胞癌,详见阿替利珠单抗。
综合上述,获批肝细胞癌适应症的药物几乎都是VEGFR抑制剂或带有抑制VEGFR的多靶点抑制剂,VEGFR抑制剂性质上是抑制血管生长,理论上对多种肿瘤有效,从FDA批准的多个产品来看,疗效确有明显的提升,但并没有从量变发展为质变。
二、免疫检查点抑制剂
01.帕博利珠单抗(商品名:Keytruda)
帕博利珠单抗于2014年获批上市,2018年获FDA加速批准用于索拉非尼治疗后进展的肝细胞癌治疗。在一项代号为KEYNOTE-224的临床试验中,104名经索拉非尼治疗后进展的HCC患者(Child-Pugh分类为A级)加入了试验,经过单臂、开放性治疗,ORR为17%,持续缓解时间超过12个月的患者比例为56%。
02.纳武单抗(Opdivo)+依匹木单抗(商品名:Yervoy)
纳武单抗于2015年获批上市,2020年获FDA加速批准用于,与依匹木单抗联用,治疗索拉非尼治疗后进展的肝细胞癌。在一项代号为CHECKMATE-040的临床试验中,49名HCC亚组(均为索拉非尼不耐受或治疗后进展的HCC,Child-Pugh分类为A级),经过本品+依匹木单抗联合治疗,ORR为33%,持续缓解时间超过24个月的患者比例为31%。
03.度伐利尤单抗(商品名:Imfinzi)+tremelimumab(商品名:Imjudo)
2017年,阿斯利康的PD-L1获得FDA批准上市,2022年获FDA批准,联合tremelimumab(CALT4抑制剂),治疗无法手术的肝细胞癌。临床试验数据显示,本品与tremelimumab联合治疗的393名患者,中位总生存期为16.4个月,而索拉非尼的389名患者为13.8个月,死亡风险下降了22%。ORR方面,本品与Imfinzi联合治疗组为20.1%,而索拉非尼组仅为5.1%,联合治疗组有3.1%的患者完全缓解,而索拉非尼组仅为0%。
04.信迪利单抗(Sintilimab)
2021年6月,信迪利单抗获NMPA批准,与贝伐珠单抗联用,一线治疗不可切除或转移性的、既往未经历过系统性治疗的肝细胞癌。在一项代号为ORIENT32的临床试验中,571名既往经历过系统性治疗、Child-Pugh≤7分、巴塞罗那分期分别为C期及B期不可切除或介入治疗的患者加入了试验,所有受试者按2:1分组,并分别接受本品+贝伐珠单抗或索拉非尼治疗,结果显示两组患者的mPFS分别为4.6个月 vs 2.8个月,mOS分别为NR vs 10.4个月,ORR分别为19.1% vs 3.8%。
05.卡瑞丽珠单抗(Camrelizumab)
2020年3月,卡瑞丽珠单抗获NMPA批准,用于既往接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌治疗。在一项代号为SHR-1210-II/III-HCC的研究中,220名Child-Pugh肝功能评级为A级或较好的B级、不适合手术或局部治疗、并且经过至少一线系统性治疗后失败或不耐受的转移性HCC患者参与了试验,主要终点为独立影像评估委员会(IRC)的ORR和6个月生存率。经过本品不同两周一次或三周一次的治疗,两周一次组或三周一次组ORR分别为14% vs 17%,mPFS分别为2.3个月 vs 2.1个月,mOS分别为14.2个月 vs 12.6个月,6个月生存率分别为79.2% vs 73.3%。
06.替雷利珠单抗(Tislelizumab)
2021年6月,NMPA批准替雷利珠单抗用于既往接受过治疗、且不可切除的肝细胞癌治疗。在一项国际多中心的2期研究中,249名不可切除的HCC患者,其中138名既往接受过一种全身性治疗、111名既往接受过至少两种,主要终点为独立影像评估委员会(IRC)的ORR。经过本品治疗,ORR为13.3%,mPFS和mOS分别为2.7个月和13.2个月。
07.阿替利珠单抗(商品名:Tecentriq)
阿替利珠单抗于2021年获得NMPA批准,联合贝伐珠单抗治疗既往未接受过全身系统性治疗的不可切除肝细胞癌。在一项代号为IMbrave150的临床研究中,501例符合入组条件的患者(Child-Pugh A级)以2:1分组分别接受本品+贝伐珠单抗或索拉非尼治疗,mOS分别为NR vs 13.2个月,6个月存活率分别为84.8% vs 72.2%,mPFS分别为6.8个月 vs 4.3个月,ORR分别为27.3% vs 17.9%。
免疫检查点抑制剂是上帝赐给肝癌患者的一大礼物,为肝癌的治疗带来了巨大的进步。或许曾经有人质疑我国的PD-1赛道过于拥挤,但对于肝癌患者而言是多多益善。由于PD-1/L1并非像小分子抑制剂一样,是针对某个适应症或某个靶点高通量筛选出来的,而更像是鸟枪法在打“适应症"。由于PD-1/L1广泛的疗效,或许PD-1/L1的设计者他也不知道他的产品会对哪些肿瘤有效,对哪些肿瘤无效,只能通过大量临床试验把疗效数据砸出来。因此,不同的PD-1/L1可能获批的适应症不同,在不同适应症上的疗效也会有巨大的差异,不是FDA批准的产品就是最好的,只有多个产品的数据对比,才能得到某个适应症领域患者获益最大的产品。
三、处于临床研究阶段的肝癌新药
肝癌信号通路极其复杂,新药研发失败率较高,获批产品临床获益也不不明显,除了免疫治疗,目前处于临床末期阶段的肝癌药物较少,包括Everolimus(mTOR抑制剂、三期)、阿昔替尼(2期)等,当然还有很多处于研发早期阶段的新机制药物。
相关阅读:
<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论