前言
近年来,ADC药物研发火热,不少国内外药企布局ADC赛道,以期在该领域分一杯羹。抗体偶联药物(Antibody–Drug Conjugates,ADC)由靶向特异性抗原的单克隆抗体药物和小分子细胞毒药物通过连接子偶联而成,兼具传统小分子化疗的强大杀伤效应及抗体药物的肿瘤靶向性。从聚焦的疾病领域来看,ADC药物集中度非常高,主要集中在肿瘤领域。其实首个ADC药物是2000年获批上市,后续ADC 在业界不温不火,直到2019年与2020年,开启了ADC批准的爆发期,FDA先后批准了5个ADC药物(Polivy、Padcev、Enhertu、Blenrep和Trodelvy)。
01 ADC药物结构及作用机制
ADC药物的三大元件包括:人源单克隆抗体、可切割/不可切割的连接子以及小分子化疗药物/细胞毒素类药物,单克隆抗体与细胞毒素类药物通过连接子偶联。简单来说,ADC药物是单克隆抗体与强细胞毒性的化疗药物通过连接子结合而成。


▲ADC药物结构(上:示意图。下:三大元件图解)
ADC作用机理简单明了,ADC药物进入体内后,抗体部分与表达肿瘤抗原的靶细胞特异性结合,ADC药物被肿瘤细胞内吞后,进入溶酶体进行降解,小分子细胞毒药物在胞内以高效活性形式被足量释放,从而完成对肿瘤细胞的杀伤。简单来说,ADC 药物进入肿瘤细胞内部后,破坏肿瘤细胞DNA,抑制肿瘤细胞分裂,杀死肿瘤细胞。

▲ADC药物作用机理示意图
02 国内ADC药物领军者

荣昌生物制药(烟台)股份有限公司创建于2008年,总部位于中国(山东)自由贸易试验区烟台片区——烟台经济技术开发区,在北京、上海、美国旧金山和华盛顿设有研发中心和分支机构,由荣昌制药和留美科学家房健民教授于2008年共同发起创办。2020年11月9日,荣昌生物在港交所挂牌上市,募集资金总额5.9亿美元,创下当年全球最大生物技术IPO记录。2022年1月11日,证监会宣布同意荣昌生物科创板注册发行,此次科创板IPO计划募资40亿元人民币。

截图来源:药融云投融资数据库
经药融云数据查询,荣昌生物截止目前共有2款药物( telitacicept(泰它西普)和 disitamab vedotin(维迪西妥单抗))上市;6款处于临床1、2期,另外还有5款药物正在进行临床前研发。荣昌生物专注在肿瘤领域进行药物研发,目前在研药物共有11款,占比64.71%。
荣昌生物已上市药物
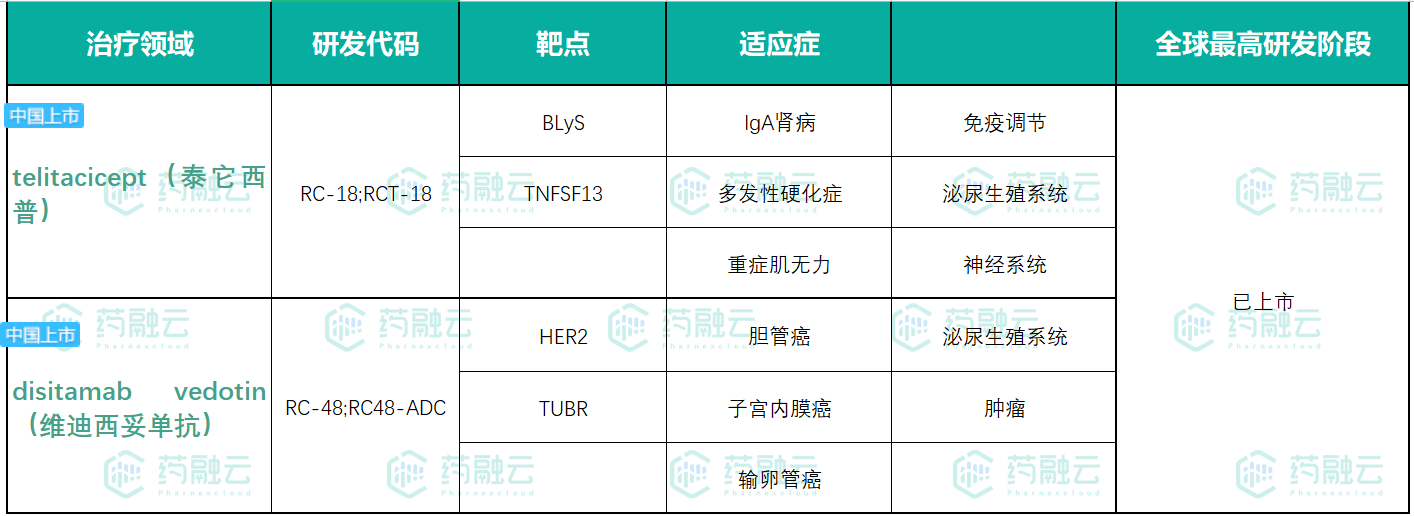
数据来源:药融云全球药物研发数据库
荣昌生物药物研发阶段
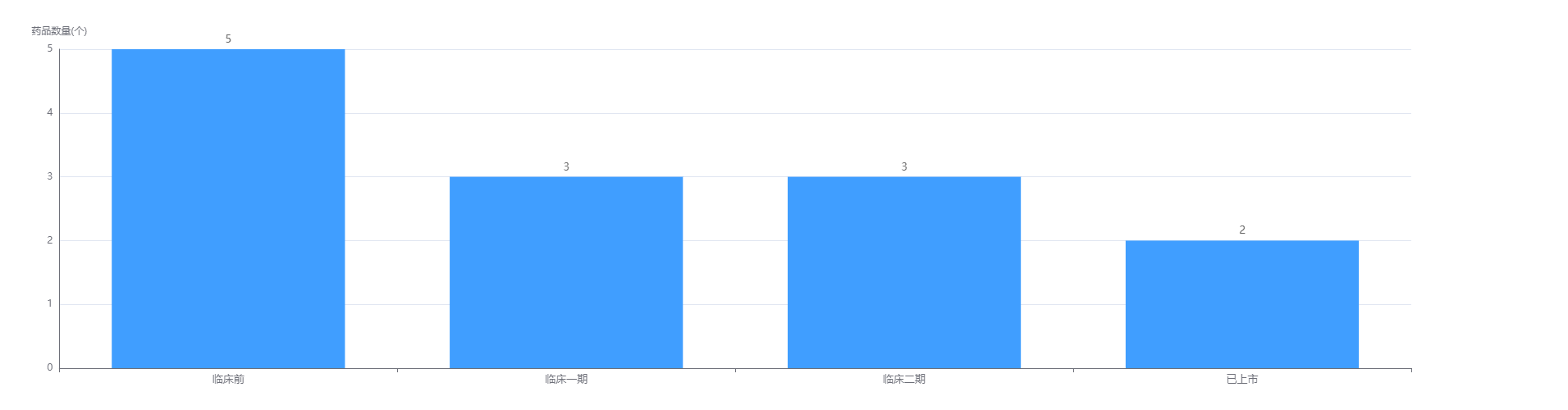
图片来源:药融云全球药物研发数据库
荣昌生物药物研发管线
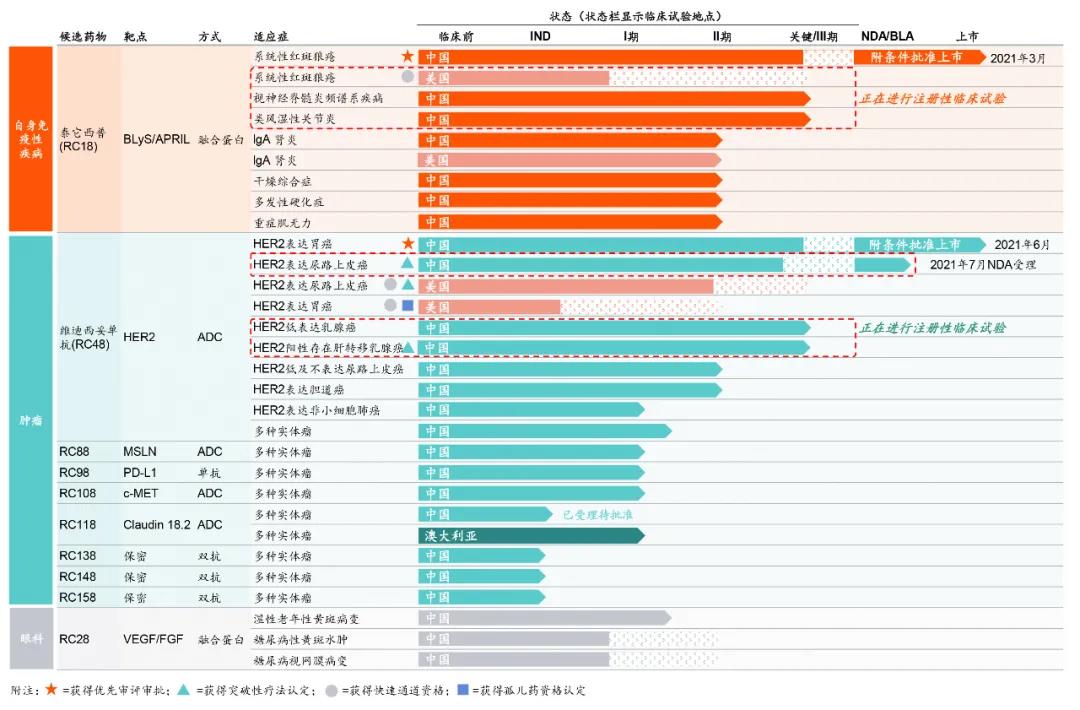
来源:公司官网
首个ADC新药获批:
HER2是一种重要生物标志物,在许多不同的组织中有普遍表达,并且其过表达已被认为是多种癌症类型的基因驱动因素。近年来,HER2已经成为全球制药公司开发ADC的主要靶点之一,HER2阳性╱高表达BC(IHC 2+/FISH+或IHC 3+)持续受到了广泛深入研究且,是唯一获准使用抗HER2 ADC治疗的癌症类型。但是,在多种其他癌症类型中,如GC(胃癌)、UC(尿路上皮癌)、BTC(胆道癌)和NSCLC(非小细胞肺癌),也观察到不同水平的HER2表达(包括低表达),BC(乳腺癌)病例中有近50%观察到中低水平HER2表达(IHC 2+/FISH-或IHC 1+),由此表明,抗HER2-ADC在HER2高表达BC之外也具有很大的治疗潜力和机会。
维迪西妥单抗(研发代号:RC48):荣昌生物自主研发的抗HER2抗体偶联药物,也是首款由中国公司自主研发的ADC。它的分子结构包括一个新型人源化HER2抗体;其连接子在肿瘤细胞具有可裂解性;其小分子细胞毒药物具有高毒性及旁观者杀伤效应。

截图来源:药融云全球药物研发数据库
2021年6月9日,中国国家药监局(NMPA)宣布,已通过优先审评审批程序附条件批准注射用维迪西妥单抗(商品名:爱地希)上市,适用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。一项2期注册性临床试验数据显示,维迪西妥单抗治疗上述适应症患者,客观缓解率(ORR)为24.4%,无进展生存期(PFS)中位数为4.1个月,总生存期(OS)中位数为7.6个月。
2021年7月初,维迪西妥单抗正式全国开售。药融云数据显示,本品价格进入医保谈判前价格为60mg/支/盒对应13500元/盒。进入医保目录后,为3800元/盒。在2022年JPM大会上,荣昌生物表示:本款HER2-ADC的销售部团队目前有200人,已覆盖30个省份130个城市的400家医院和405家药店。

【商品名】:爱地希® 【通用名】:维迪西妥单抗
2022年1月5日,荣昌生物宣布:注射用维迪西妥单抗(商品名:爱地希®)新适应症获得国家药品监督管理局(NMPA)的上市许可批准,用于治疗既往接受过含铂化疗且HER2过表达即免疫组化检查结果为2+或3+的局部晚期或转移性尿路上皮癌患者。该适应症于2021年7月14日提交上市申请获受理,耗时5个月迅速获批,成为国内首个靶向HER2治疗尿路上皮癌的ADC药物。

流行病学数据显示,尿路上皮癌是常见恶性肿瘤之一,发病率及死亡率均占男性泌尿生殖系统肿瘤的首位,九成起源于膀胱,也可见于肾盂、输尿管。据沙利文报告,全球新增尿路上皮癌病例于2030年将达到约66.2万例,2025年至2030年复合年增长率为2.5%;在中国,尿路上皮癌的发病率增速高于全球水平,预计于2030 年将达到约10.6万例。统计显示,该病复发率和转移率较高,约20%的患者确诊时已发生转移或病程已进展至不可切除阶段,现有治疗手段远未满足巨大的临床需求。
值得注意的是,荣昌生物在2021年8月与国际知名生物制药公司西雅图基因(Seagen Inc. 纳斯达克:SGEN)达成一项全球独家许可协议:针对荣昌生物的ADC新药维迪西妥单抗(RC48,商品名:爱地希),Seagen 将付出 2 亿美元首付款+最高 24 亿美元的里程碑付款,以获得该药物全球部分地区的开发和商业化权益。目前已经收到了2亿美元首付款。
03 ADC国内布局企业
药融云数据显示,国内在开发ADC药物的企业有:恒瑞医药、荣昌生物、豪森药业、石药集团、基石药业、宜联生物、百奥泰、百力司康、博安生物、百利药业、无锡智康弘义生物、启德医药、Anwita Biosciences、英诺迈博、映恩生物、Adcentrx Therapeutics、新码生物、多禧生物、科伦药业、百济神州、烨辉医药、德琪医药、康威生物、诗健生物、应世生物、齐鲁制药、美雅珂/乐普生物、达石药业、天广实、普方生物(ProfoundBio)、尚健生物、丽珠生物、广州麓鹏制药、和元艾迪斯、保合安特生物、诺灵生物、君实生物、东曜药业、上海医药、复旦张江、嘉和生物、新理念、礼新医药、康明百奥、天士力生物、联宁(苏州)生物、复宏汉霖、特瑞思/珍宝岛、海正药业、三生国健、高田生物、康源久远、云顶新耀、杭州爱科瑞思、博奥信生物、普众发现等等。
国内ADC药物研发管线超120个,研发企业近70家

▲图片来源:药融圈旗下 生物药大时代 制图
04 ADC肿瘤市场预测

2021年的Nature Reviews Drug Discovery,“The oncology market for antibody-drug conjugates”一文中预计2026年,目前已上市ADC的全球销售额将超过164亿美元;其中,Enhertu或将以62亿美元成为销量最高的ADC;而T-DM1销售额将为23亿美元。Enfortumab vedotin被批准用于既往治疗过的的转移性尿路上皮癌,预计2026年全球销售额达到35亿美元。热门的Trop-2药物Sacituzumab-govitecan预计为11亿美元,用于乳腺癌和尿路上皮癌等等。
参考:
NMPA/CDE;
药融云数据,www.pharnexcloud.com;
FDA/EMA;
相关公司公开披露;
Nature Reviews Drug Discovery. The oncology market for antibody-drug conjugates. 2021,
https://doi.org/10.1038/d41573-021-00054-2;
http://www.remegen.cn/;
https://remegen.com/zh-hans/pipeline/;
荣昌生物的港股招股书,https://www1.hkexnews.hk/listedco/listconews/sehk/2020/1028/2020102800024_c.pdf;
http://www.csrc.gov.cn/pub/shandong/sdfdqyxx/sdfdqyjbqk/202103/t20210308_393748.htm;
艾伯维ADC获FDA 突破性疗法认定;国内ADC企业一览;
等等。
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论