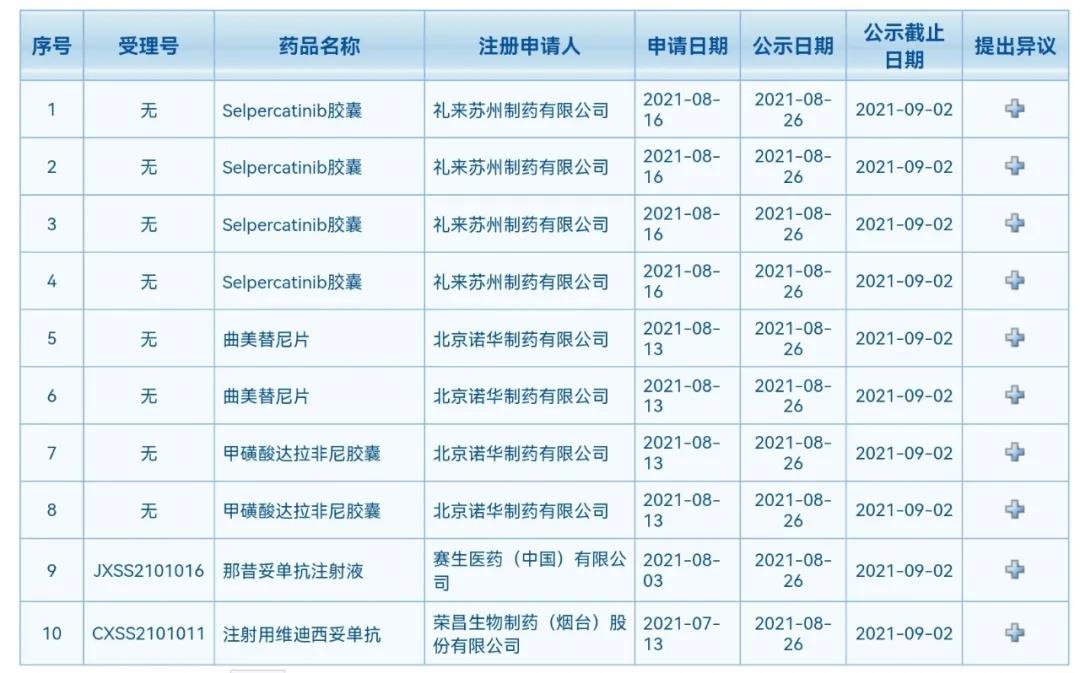
据CDE官网,5品种上市申请被拟纳入优先审评审批,包括礼来的Selpercatinib胶囊、北京诺华的曲美替尼片和甲磺酸达拉非尼胶囊、赛生医药的那昔妥单抗注射液,以及荣昌生物的注射用纬迪西妥单抗。
一、Selpercatinib:RET抑制剂
Selpercatinib是礼来研发的一种强效、口服、高度选择性转染期间重排 (Rearranged During Transfection, RET) 激酶抑制剂,同时也是首个靶向 RET 激酶的抑制剂,通过抑制异常 RET 激酶的活性而发挥作用。
该药已先后获得美国 FDA 三项突破性疗法认证和优先审评审批资格,并于 2020 年 5 月 8 日经美国 FDA 批准上市(商品名 Retevmo),适用于甲状腺肿瘤、甲状腺髓样瘤和转移性非小细胞瘤。同时,在欧盟和美国也有多个适应症已提交上市申请,在国内的研发最高已到III期临床阶段。
Selpercatinib在中美及欧盟的研发/上市状态
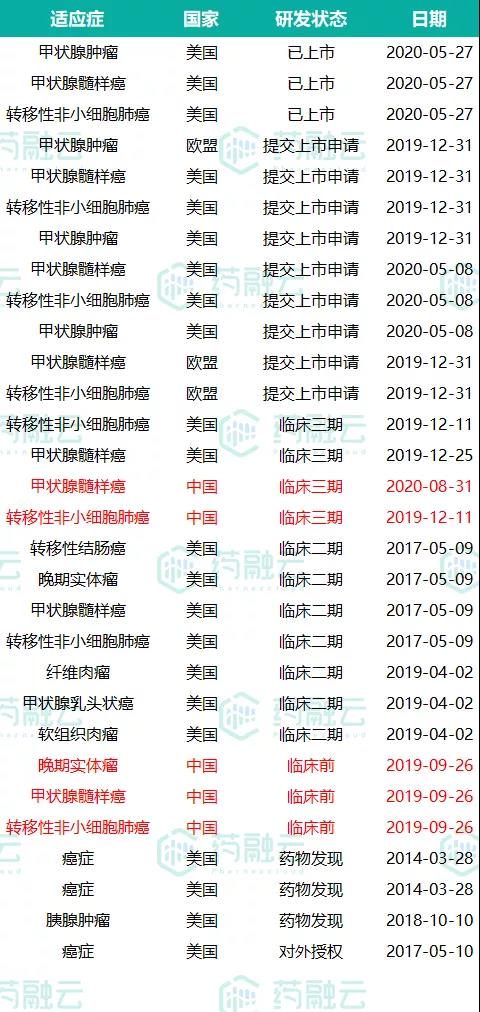
来源:药融云全球药物研发数据库
二、曲美替尼+达拉非尼:可双靶向联合治疗
达拉非尼和曲美替尼均为GSK研发的BRAF/MEK抑制剂,现归诺华所有。这两种药物联合使用,可以同时抑制BRAF和MEK两个靶点,达到比单药更好的效果。多项全球关键性临床研究结果显示,对比靶向单药治疗,达拉非尼和曲美替尼联合使用可帮助晚期BRAF V600突变黑色素瘤患者,得到更高的疾病缓解,实现更长的无进展生存。
2019年12月,该组合在国内上市,NMPA批准达拉非尼与曲美替尼用于治疗BRAF V600突变阳性的不可切除或转移性黑色素瘤;2020年3月,达拉非尼与曲美替尼再次获批联合用于BRAF V600突变阳性的III期黑色素瘤患者完全切除后的辅助治疗。
三、那昔妥单抗注射液
那昔妥单抗是是全球首款获批的人源化神经节苷脂GD2单克隆抗体,已于2020年11月在美国获批治疗神经母细胞瘤患者。该药曾获FDA授予的优先审评资格、突破性疗法认定和孤儿药资格。
在国内,赛生药业与其原研药企Y-mAbs Therapeutics达成独家授权许可协议,获得了那昔妥单抗在大中华地区的独家合作开发和商业化权利,并在博鳌乐城率先落地这款创新的免疫治疗药物,惠及国内神经母细胞瘤患儿。
那昔妥单抗基本信息

今年7月,在美国获批上市仅七个多月后,赛生药业就已向中国国家药品监督管理局(NMPA)正式递交那昔妥单抗(naxitamab-gqgk,Danyelza)的上市许可申请并获受理。
四、注射用维迪西妥单抗
6 月 9 日,注射用维迪西妥单抗通过优先审评程序获国家药监局附条件批准上市,适用于至少接受过 2 种系统化疗的 HER2 过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。这将是国内第三个获批的ADC抗体,也是首个国产ADC药物。
据悉,荣昌生物已经为维迪西妥单抗建立了2000L规模的细胞培养生产线、小分子合成、偶联及ADC制剂罐装生产线,为商业化生产做好了充分准备。
此外,2020年11月,FDA授予维迪西妥单抗治疗胃癌适应症的快速通道资格。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论