
1月16日,NMPA 官网显示,英派药业PARP抑制剂“塞纳帕利”获批上市,适用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在一线含铂化疗达到完全缓解或部分缓解后的维持治疗。
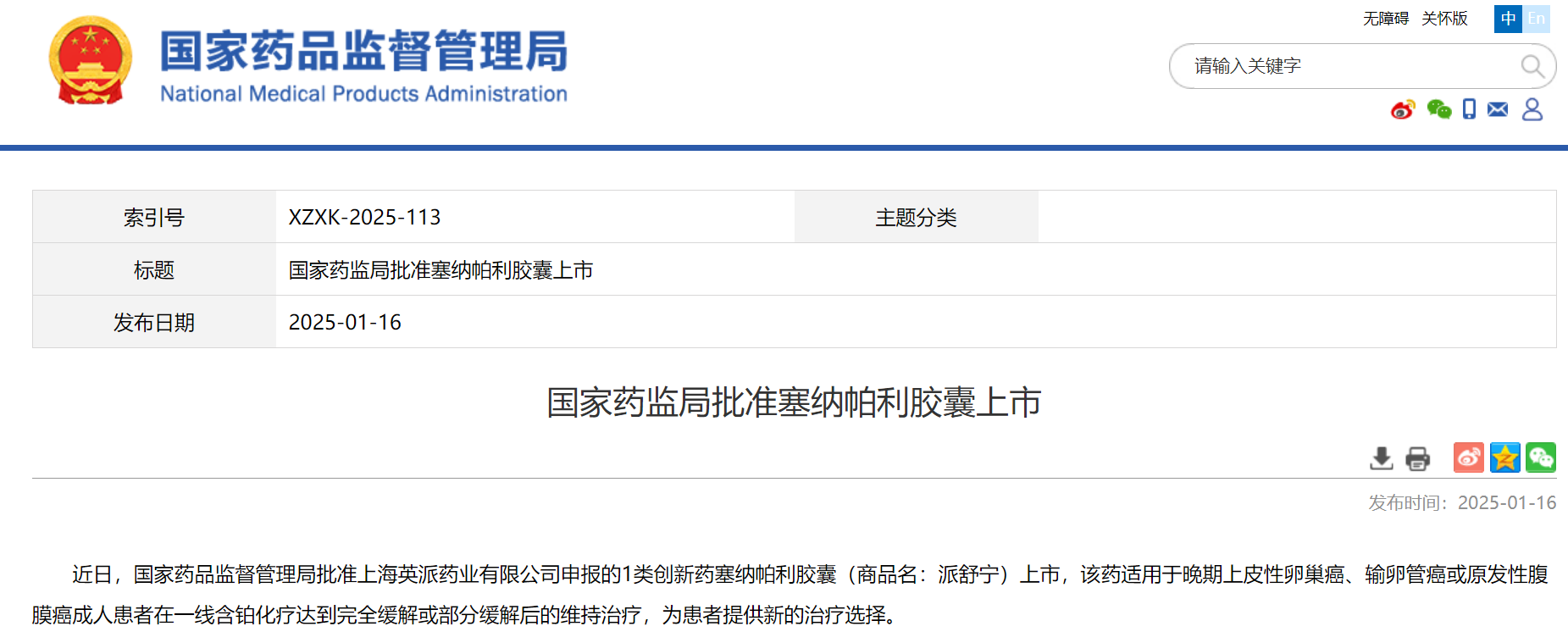
截图来源:NMPA官网
塞纳帕利是由英派药业自主研发的新型、高效的PARP1/2抑制剂,具有独特的分子结构,使其具备体外和体内高活性,以及高靶向选择性和广泛的安全窗口。塞纳帕利的获批是基于FLAMES研究,该研究是一项随机、双盲、安慰剂对照、多中心的3期临床研究,旨在评价一线含铂化疗达到完全缓解(CR)或部分缓解(PR)后塞纳帕利单药维持治疗晚期卵巢癌患者的有效性和安全性。
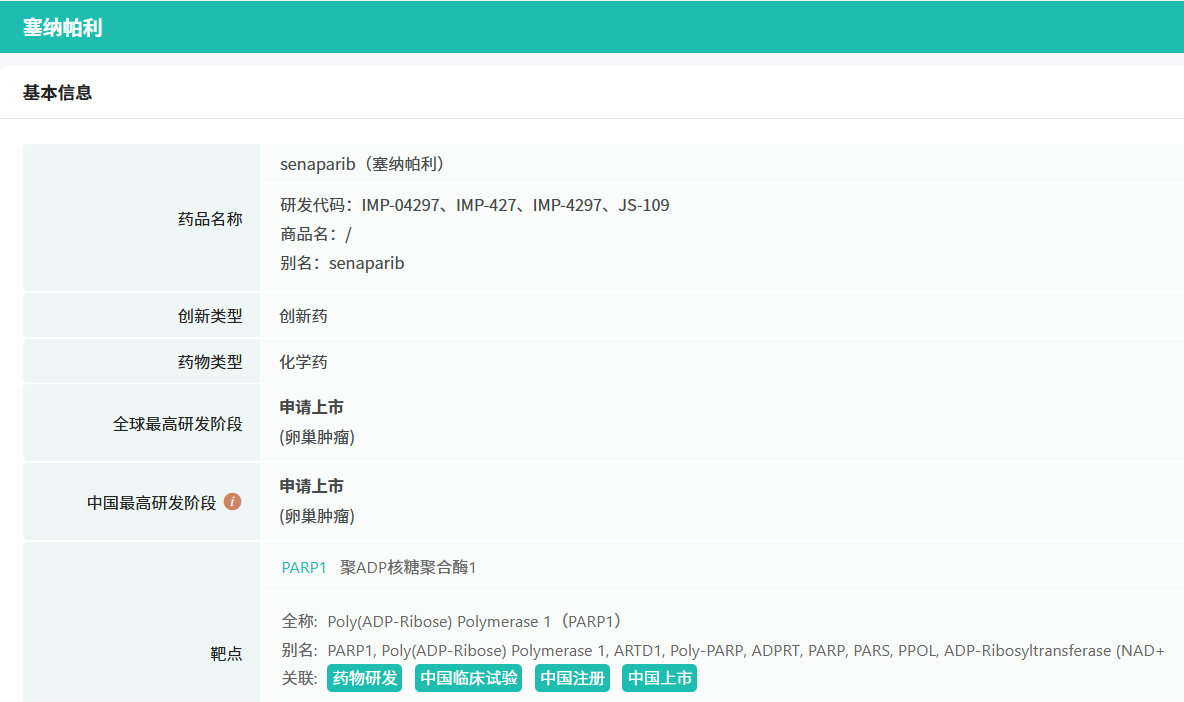
截图来源:摩熵医药全球药物研发数据库
该药最早于2016年4月首次申请临床,次年4月首次公示启动临床试验。2023年4月,该药用于晚期卵巢癌全人群一线维持治疗的 III 期临床试验达到主要终点,同年8月申请上市,今日终于获批上市,历时17个月。据摩熵医药数据库显示,国内已有6款PARP1/2抑制剂获批上市。

本次上市获批是基于FLAMES III期临床试验(试验登记号:NCT04169997/CTR20192330)的积极成果。在2023年欧洲肿瘤内科学会(ESMO)大会上,英派药业通过口头报告形式公布了这一重要试验结果。FLAMES研究聚焦于新诊断的、FIGO分期为III-IV期的高级别浆液性或子宫内膜样卵巢癌患者,这些患者在完成一线化疗并取得完全缓解(CR)或部分缓解(PR)后,按2:1的比例随机分配至每日口服100毫克塞纳帕利组或安慰剂组。
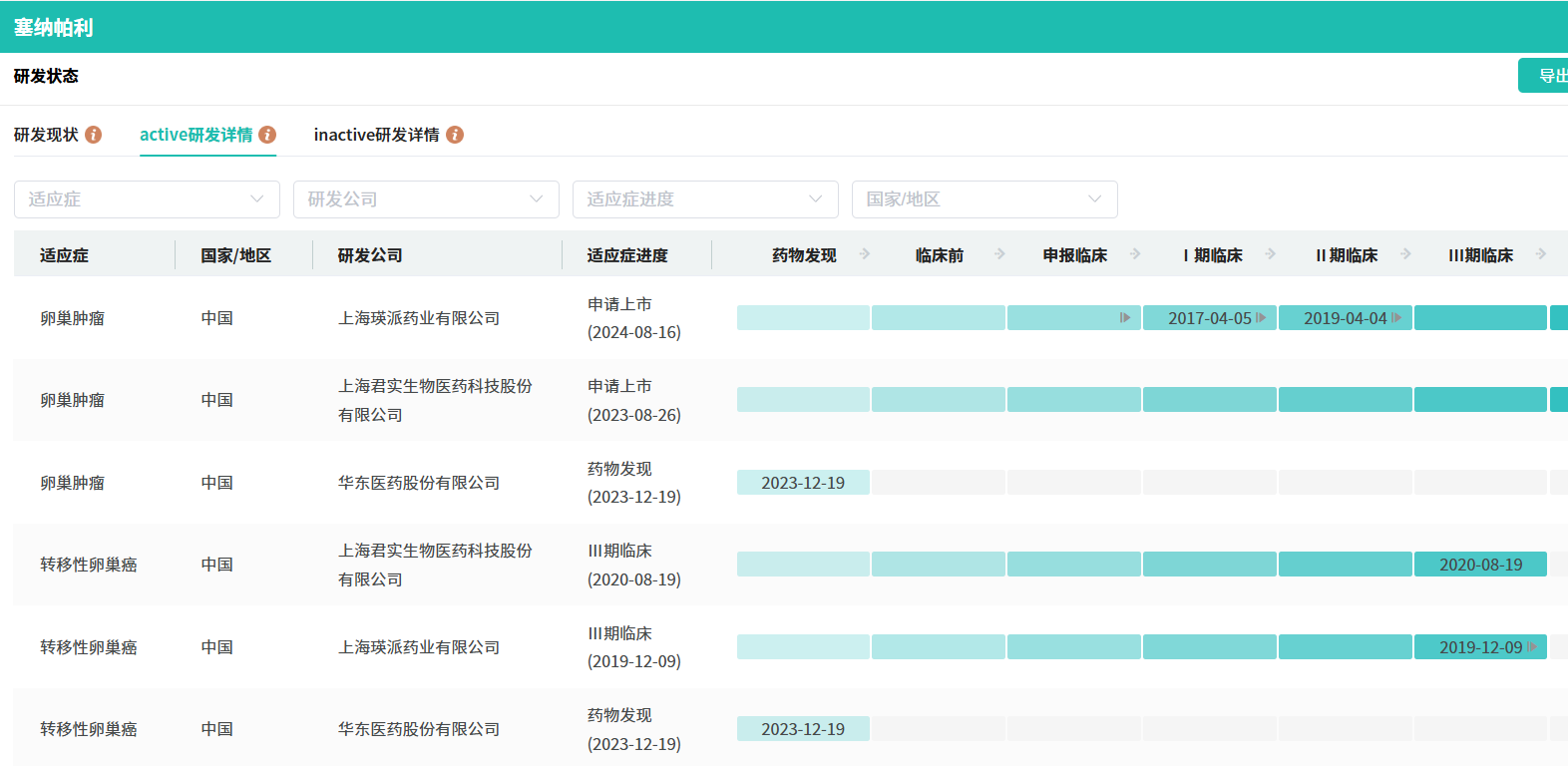
截图来源:摩熵医药全球药物研发数据库
该研究的主要终点是通过盲态独立中心审查(BICR)评估的无进展生存期(PFS)。结果显示,塞纳帕利组相比安慰剂组显著延长了PFS(未达到对比13.6个月,风险比HR为0.43)。这一改善在BRCA突变阳性组(未达到对比15.6个月,HR 0.43)和BRCA突变阴性组(未达到对比12.9个月,HR 0.43)中均得到体现。
在安全性方面,塞纳帕利表现出良好的整体耐受性,未观察到新的安全信号。具体而言,塞纳帕利组和安慰剂组发生≥3级不良事件(AE)的比例分别为66.3%和20.3%;导致剂量减少的AE比例分别为63.3%和6.0%;停药比例分别为4.4%和0%。值得注意的是,本研究中未报告任何导致死亡的AE。
参考来源:
[1] NMPA官网
[2] 摩熵医药(原药融云)数据库
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论