
Denali Therapeutics是一家专注于神经退行性疾病的生物技术新锐。自Biogen获得合作开发和商业化Denali小分子LRRK2抑制剂的许可后,扩大了帕金森氏病和其他运动障碍的潜在疗法产品线,在临床前与临床1期和1b期中获得积极研究成果并发表在《科学》子刊Science Translational Medicine上,为帕金森病患者带来新的治疗希望。

而近日Denali与武田公司(Takeda)达成协议停止另一种阿尔茨海默氏症(AD)候选药物DNL-919(ATV:TREM2)的临床开发,该药物是一种抗体转运载体(ATV)可以激活TREM2。TREM2是一种在小胶质细胞中表达的蛋白质,而小胶质细胞是大脑的常驻免疫细胞。TREM2基因的突变与神经炎症和AD风险增加密切相关。DNL-919曾于2022年1月被FDA拒绝进入临床,在Denali调整了I期方案、知情同意书和研究者手册后获得了批准,于7月顺利开展。

在1期研究中,DNL919在临床上具有良好的耐受性,其脑脊液生物标志物已显示出变化,并且没有严重不良事件的发生;然而,在最高测试剂量下观察到中等、可逆的血液学效应,表明对于AD患者群体的治疗窗很窄。Stifel 公司的分析师Paul Matteis援引Denali公司高管的话说,这种影响具体表现为贫血,这可能由TREM2和TfR1结合的产物会引起免疫反应,对转铁蛋白功能产生影响引起的。因此,Denali 和武田今后将重点研究临床前开发中的备用分子,包括最近批准的治疗AD的新药物,探索潜在的联合疗法。

该生物技术公司在其第二季度更新报告中写道:“这是一项战略决策,基于DNL919在健康志愿者中进行的单次递增剂量1期研究中得出的全部临床数据,并考虑到阿尔茨海默氏病快速发展的治疗前景,从而了解与新批准的疗法的药物组合。第一阶段数据的初步分析表明,DNL919对小胶质细胞生物标志物(例如,CSF1R、SPP1、IL1RA、IP10、MIP1b、MCP-1)具有很大影响,这与临床前研究结果中 ATV:TREM2会诱导诱导小胶质细胞的反应状态发生强有力的变化相一致。
DNL919基本信息
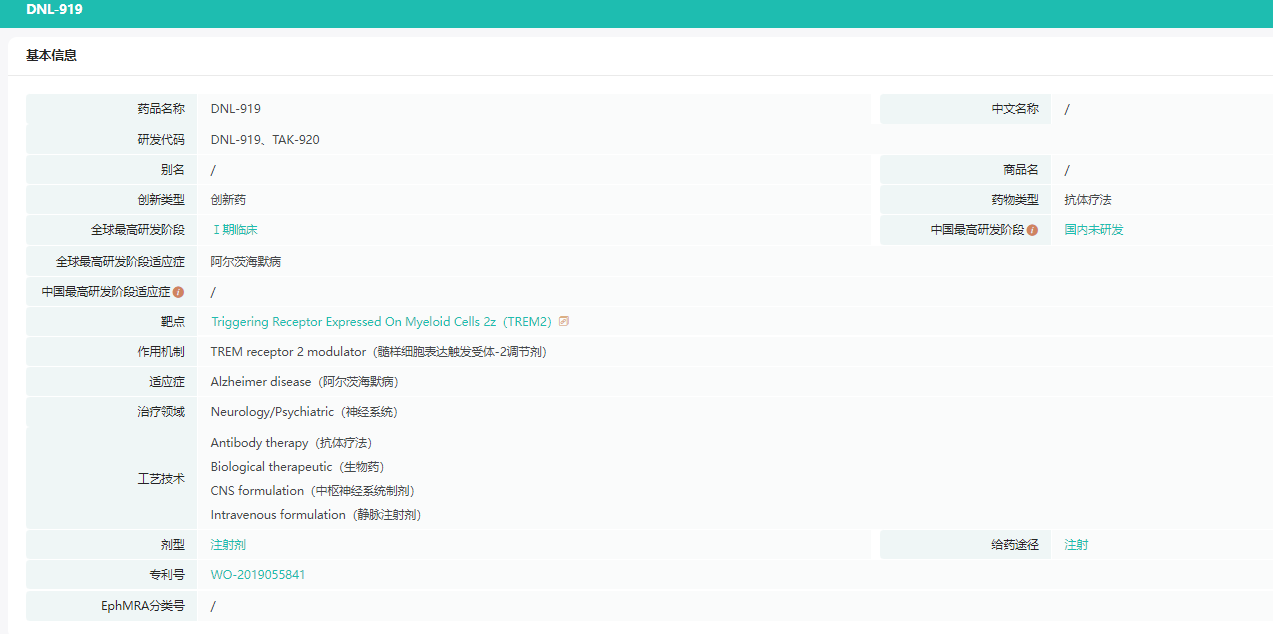
截图来源:药融云全球药物研发数据库
Denali研发管线及进展
目前Denali专有的药物输送平台技术包括抗体转运载体和酶转运载体,旨在将大分子输送穿过血脑屏障(BBB)。其管线产品旨在治疗阿尔茨海默氏病、额颞叶痴呆症、帕金森氏病、溶酶体贮积症、全身炎症(皮肤红斑狼疮、溃疡性结肠炎)、神经退行性疾病(肌萎缩性侧索硬化、多发性硬化症)等疾病。
该公司在溶酶体方向布局了5条研发管线,基于TV技术进展最快的药物,是针对黏多糖贮积症II型(MPS II,又名亨特综合征)的DNL310;溶酶体方向的另一款药物DNL151,是一款小分子亮氨酸重复激酶2(LRRK2)抑制剂,也是Denali的明星药物。神经胶质细胞方向布局了1条研发管线,DNL788是一款小分子RIPK1抑制剂,用于治疗阿尔茨海默征、肌肉萎缩性侧面硬化征(ALS)和多发性硬化病(MS)。细胞稳态方向布局了2条研发管线,其中进入研发阶段的产品为DNL343,这是一款小分子药物,旨在通过恢复蛋白质翻译和RNA的代谢来恢复正常的EIF2B功能以减少疾病中发生的细胞稳态障碍。在其他方向上,已经进入临床阶段的产品还包括小分子药物DNL758,主要开发适应症包括皮肤红斑狼疮(CLE)和COVID-19。

Denali研发管线
Denali指出,武田合作的另一个项目--支持蛋白转运载体的原粒细胞蛋白替代疗法DNL593仍处于I/II期。该公司最近报告了健康志愿者的初步数据,但目前正在招募前颞叶痴呆-粒蛋白患者参加第二部分试验。
武田研发管线及进展
武田制药的研发主要集中于五大主营领域:消化系统,罕见病,血液制品,神经科学,肿瘤。
近日,武田也公布了2023年第一季度财报,从治疗领域来看,其胃肠道疾病领域产品2023Q1收入占总收入28%,同比增长3%;罕见病领域收入占总收入18%,同比增长2%。神经领域、肿瘤、血源性产品收入分别占比17%、10%、18%。从具体产品上看,溃疡性结肠炎、克罗恩病治疗药物Entyvio (维得利珠单抗)是武田收入最高的产品,2023Q1销售额达到1920亿日元(+14.1%)。
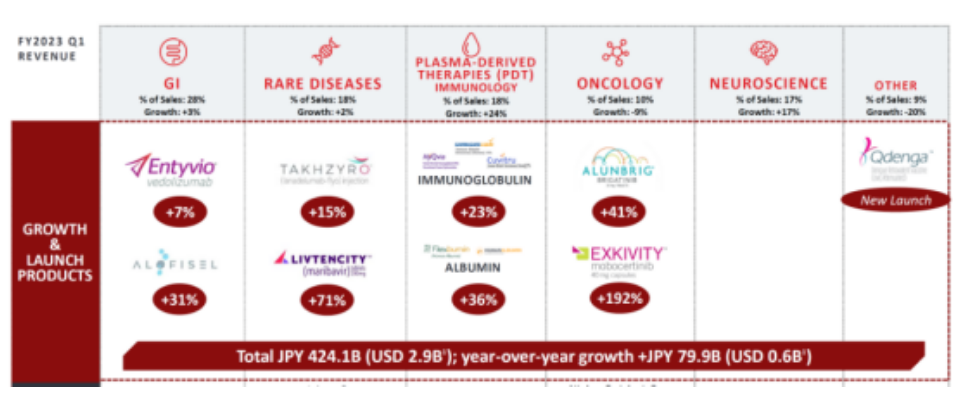
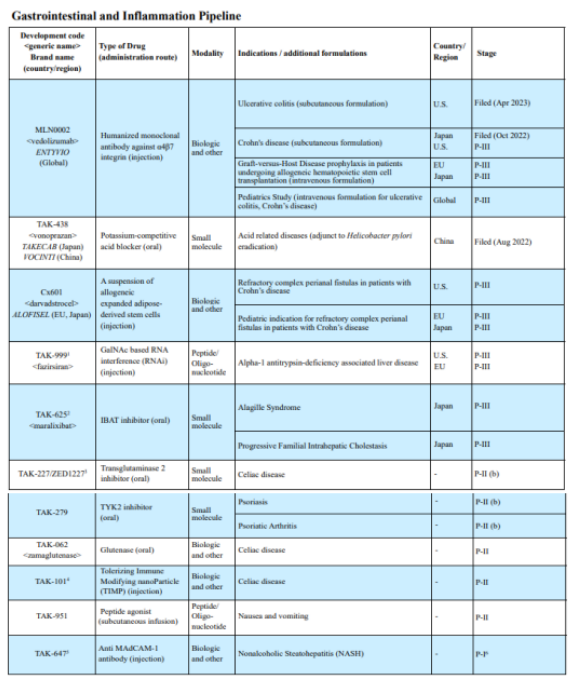
该公司在胃肠道及炎症研发管线上共布局了11种产品,武田已提交新型抗炎药Entyvio(vedolizumab,MLN0002)治疗中度至重度活动性克罗恩病(CD)成人患者的新适应症申请;Darvadstrocel(Cx601),用于治疗非活动性/轻度活动性管腔CD成人患者的复杂肛瘘已进入临床III期;武田与Arrowhead Pharmaceuticals共同开发的fazirsiran(TAK-999)2021年7月获得FDA的突破性治疗指定认证,并于2018年2月获得孤儿药指定认证,用于治疗α-1抗胰蛋白酶缺乏;2019年10月,武田和COUR Pharmaceutical达成协议,获得CNP-101(TAK-101)的全球独家开发和商业化许可。
TAK-101是一种含有麦胶蛋白的免疫修饰纳米颗粒,在乳糜泻患者参加的随机、双盲、安慰剂对照IIa期临床试验中较安慰剂显露出了优势;2020年2月,武田以约3.3亿美元的金额收购PvP Biologics,Zamaglutenase (TAK-062)是一种酶疗法,旨在改善麸质消化的超级麸质酶,TAK-062治疗乳糜泻患者的临床试验已进入临床II期;2022年10月,武田与Zedira和Dr. Falk Pharma达成合作,共同开发乳糜泻药物ZED1227/TAK-227现已进入临床II(b)期;2023年3月18日,武田宣布TYK2抑制剂TAK-279治疗中至重度斑块型银屑病的II(b)期临床试验中取得了积极数据。
TAK-101信息
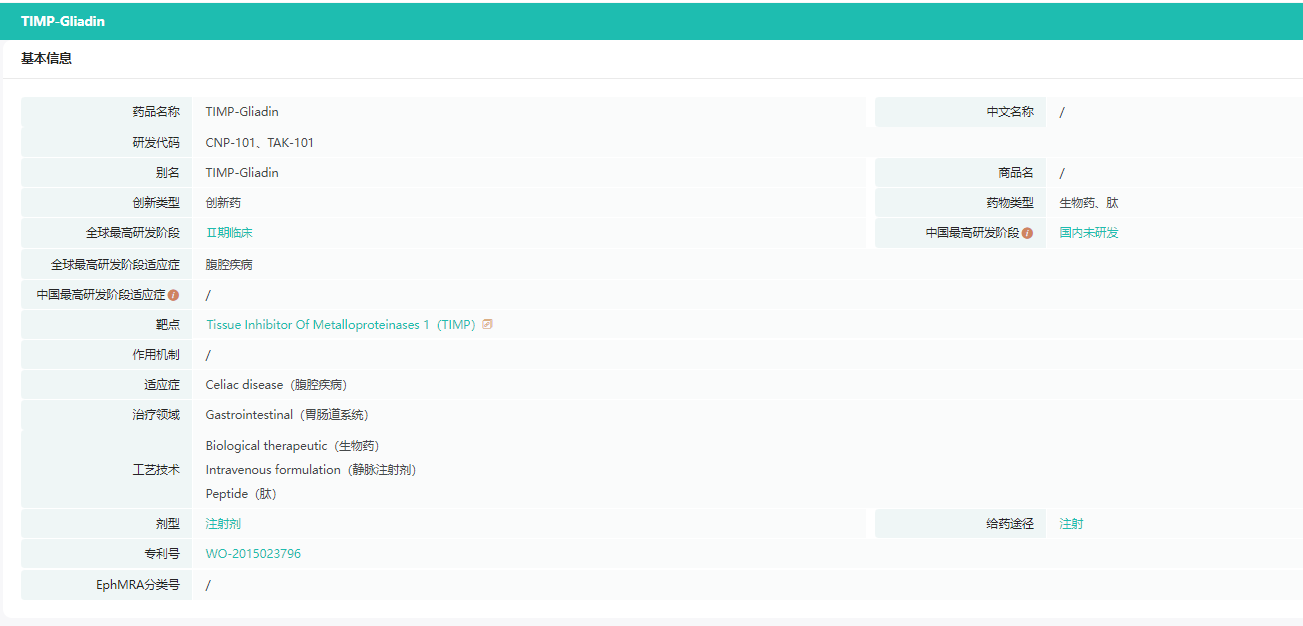
截图来源:药融云全球药物研发数据库
武田研发管线
总结
神经退行性疾病新药开发成功率极低,被称为“天坑”的AD领域有百余款新药均研发失败,临床失败率高达97.3%,Biogen已上市的两款Aβ药物也备受争议。像Denali和武田这类深耕于现有机制又不断创新递送技术的企业或许可以带来思路。不过,药物的研发始终需要时间与等待,药物的退出并不代表希望消失,期待未来更多中枢神经系统疾病领域企业强强联手,啃下难治神经退行性疾病这块“硬骨头”。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论