
由于“潜在的质量问题”,诺华已停止在美国供应两种放射性药物 Lutathera 和 Pluvicto 。
诺华公司周四宣布,将自愿暂停其位于意大利伊夫雷亚和新泽西州米尔本的抗肿瘤药物 Lutathera 和 Pluvicto 的生产。由于在制造过程中发现了潜在的质量控制问题,诺华出于“非常谨慎”的态度采取了这一行动。

暂停将影响商业和临床试验的供应。诺华将不会向美国或加拿大交付Lutathera,也不会向美国交付Pluvicto。诺华预计,一些剂量的Lutathera将从其位于西班牙的生产基地在欧洲和亚洲供应,尽管交货预计会延迟。

在调查和解决生产问题期间,评估这两种疗法的临床试验也将暂时暂停。诺华公司表示,目前没有迹象表明,之前在这两个治疗点服用过治疗药物的患者有任何风险,并已通知治疗点密切监测已经注射过药物的患者。另外,诺华预计在卫生当局调查后,将在6周内恢复供应。
Lutathera 和 Pluvicto 都是放射配体疗法,该地区的首席执行官 Vas Narasimhan 将其标记为瑞士制药公司与 RNA 药物以及细胞和基因疗法一起的关键先进技术平台之一。
根据诺华公司的说法,放射配体疗法将治疗性放射性同位素与细胞靶向化合物或配体结合起来。放射性同位素在特殊的核反应堆中产生,然后在生产设施中与配体结合。成品被包装成特殊的铅屏蔽容器,并直接运往处理地点。
这并不是诺华第一次在制造一种先进疗法上遭遇挫折。在CAR-T细胞疗法Kymriah治疗血癌的早期发布期间,诺华一直在努力保持最终产品在商业规格内。在某种程度上,最初的小挫折挫伤了医生对Kymriah的信心,他们更青睐吉利德的CAR-T药物Yescarta。
诺华可能会对暂停供应Pluvicto感到失望。据药融云数据库显示,Pluvicto今年3月刚刚获得美国食品和药物管理局(fda)批准,用于治疗进行性、psma阳性的转移性去势耐药前列腺癌。Pluvicto是一种放射治疗,是一种精确的癌症治疗,结合恶性靶细胞和放射性同位素的能量释放破坏癌细胞。在临床试验中,治疗加标准护理与单独标准护理相比,死亡风险和放射疾病进展风险降低了38%。在FDA宣布批准的时候,诺华曾表示打算在几周内将药物分发给医生。另一方面,Lutathera自2018年1月FDA批准其用于胃肠道神经内分泌肿瘤(GEP-NETs)的治疗以来就已开始供医生使用,GEP-NETs是一种影响胰腺或胃肠道的癌症肿瘤。服用Lutathera的患者通常每8周注射一次,总共注射4次。目前还不确定正在接受积极治疗的患者会如何受到供应链问题的影响。
Pluvicto药品信息
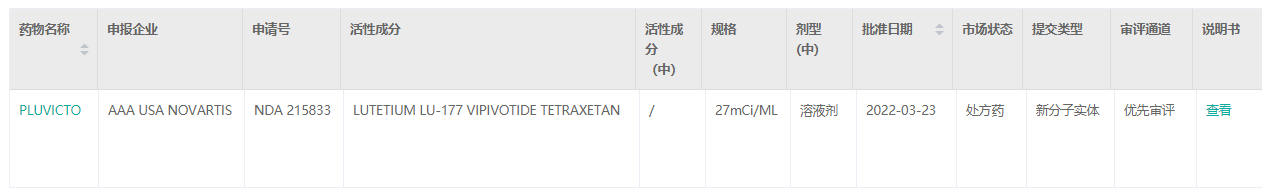
Lutathera药品信息

截图来源:药融云美国FDA批准药品数据库
诺华正在进行几项使用Pluvicto和Lutathera的临床试验,这些试验将受到生产问题的影响。目前,Pluvicto正在进行两项III期临床试验,一项是针对转移性激素敏感性前列腺癌患者,另一项是针对转移性去雄抵抗性前列腺癌患者的预紫杉烷。Lutathera目前正在进行4项临床试验,其中3项处于II期。II期临床试验涵盖多种适应症,包括儿童人群的胶质母细胞瘤、GEP-NETs,并作为广泛期小细胞肺癌的一线治疗。该疗法也正在进行第一批2级或3级GEP-NETS的III期临床试验。
参考资料:
https://www.fiercepharma.com/manufacturing/novartis-halts-us-production-radioligand-cancer-therapies-citing-manufacturing
https://www.novartis.com/news/media-releases/novartis-provides-update-production-radioligand-therapy-medicines
想要解锁更多药企药物信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企药物基本信息、研发阶段、临床试验信息、最新进展、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论