
注射剂包装系统无质量风险是注射剂产品质量以及安全性合格的重要前提,那么这部分研究思路是怎样的,如何撰写申报资料以达到CDE审评要求呢?本文将对包装系统研究思路以及资料撰写思路进行讨论。包装系统研究主要有包装系统基本信息获取、包装系统的选择及匹配性、包材性能的对比以及包材相容性四个部分组成,由于篇幅有限本文主要介绍前三部分内容。
一、包装系统基本信息
撰写要点:最好用表格形式将所使用的包装容器及配件基本信息一一罗列,基本信息主要包括所用配件及包装系统的材质、执行标准、CDE包材登记情况及登记号等。除这些基本信息需要提供外,还需要提供包材的厂家资质,主要包括:包材授权厂家使用书、CDE登记截图、供货协议、审计报告、发票、质量标准及检验报告等。如下表:
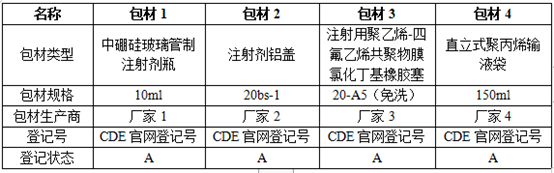
二、包装系统的选择及匹配性
撰写要点:
1.需结合稳定性研究进行不同包材来源质量确认,说明包装系统的质量及部件是否匹配;
2.如果是创新药可免去参比制剂包材对比研究,若为仿制药,则需说明参比制剂使用的内包材,以及本产品的内包材是否与参比制剂保持一致:①若包材尺寸与参比不一致(如西林瓶规格及胶塞规格不一致),应结合产品质量以及临床用法证明其使用的合理性;②若包材材质与参比不一致,应提供充分的研究依据以及文献依据证明包材选择的合理性,主要包括以下几个方面:
1)与参比制剂全面的质量研究对比包括稳定性实验质量的一致性;
2)全面的包材相容性研究资料的提供;
3)包材的质量及性能与参比制剂质量是否等同;
4)可查询欧美日同类产品(参比及仿制药)包材是否具有一致性等。
举例如下:
1. 玻瓶来源筛选
根据《USP<1660>玻璃内表面耐受评估指南》及《化学药品注射剂与药用玻璃包装容器相溶性研究技术指导原则(试行)》,选择厂家1、厂家2的5ml中硼硅玻璃管制瓶进行加速脱片考察,并对玻璃碎片(瓶身及瓶底)进行扫描电镜观察药液是否对玻瓶有腐蚀作用,筛选质量合格的玻瓶厂家。结果如下:
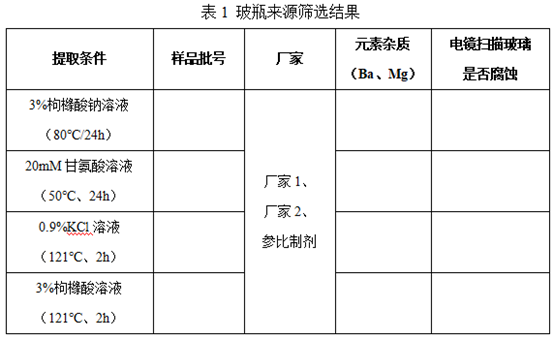
结果显示:XX厂家中硼硅玻璃管制瓶元素杂质水平与参比制剂相当或优于参比制剂,电镜扫描结果显示,药液对玻瓶碎片无腐蚀性。综上:选择XX厂家中硼硅玻璃管制瓶作为自研内包材。
2. 胶塞来源筛选
配制一批药液,选择不同厂家生产的不同种类的注射液用胶塞作为包装密封件,所有批次样品选择相同厂家的铝塑盖轧盖,121℃12min灭菌后样品于高温(60℃)、光照(4500±500LX),加速(40℃75RH%)条件下倒放一个月,结合胶塞穿刺落屑考察胶塞对产品质量的影响。结果如下:
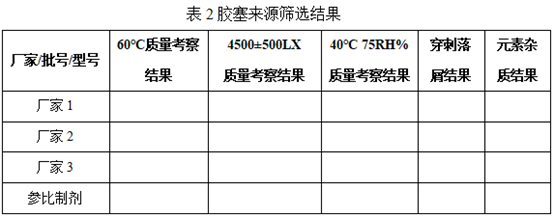
备注:表格仅供参考,实际表格样式根据读者实际情况进行设置
结果显示:XX厂家注射用聚乙烯-四氟乙烯共聚物膜氯化丁基橡胶塞质量等同于参比制剂。综上:选择XX厂家注射用聚乙烯-四氟乙烯共聚物膜氯化丁基橡胶塞。
3. 包装系统匹配性考察
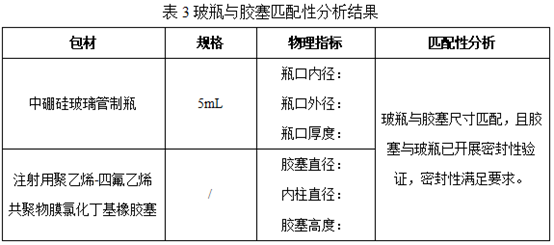
3.1 玻瓶与胶塞匹配性分析考察
我公司选用的XX厂家XX厂家中硼硅玻璃管制瓶,规格5mL,选择与瓶口内径11.6mm±0.2mmx相匹配的XX厂家注射用聚乙烯-四氟乙烯共聚物膜氯化丁基橡胶塞,内柱为13.25±0.12mm。结果见下表:
3.2 铝塑组合盖与玻瓶、胶塞的匹配性分析
轧盖密封性验证及产品密封性验证研究内容应在产品工艺验证时做,采用培养基模拟罐装并对培养基进行无菌检查(稳定性放样定点取样检测)。
密封性研究验证结果表明:该包装系统密封性符合生产工艺要求,产品质量得到充分保证。
三、包材质量与性能对比研究
撰写要点:参考YBB00252003-2015(玻璃颗粒在121℃耐水性测试及分级)、YBB00242003-2015(121℃内表面耐水性测试法和分级)标准,再结合产品稳定性考察进行包材性能对比研究,说明产品质量满足要求。若产品使用的是软塑包装(半通透性),该部分应重点关注包材阻水性、阻氧性、遮光性能等方面;若为玻瓶包装,重点关注玻瓶内表面耐水性、遮光性、121℃颗粒耐水性等包材性能。
结果显示:自研使用的中硼硅玻璃管制瓶质量与参比制剂玻瓶均满足指标要求:耐热冲击符合规定,内表面耐水性达到HC1级,121℃颗粒耐水性达到1级要求,结合稳定性数据结果,自研包材质量与参比制剂等同,自研包材能满足产品质量要求。
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论