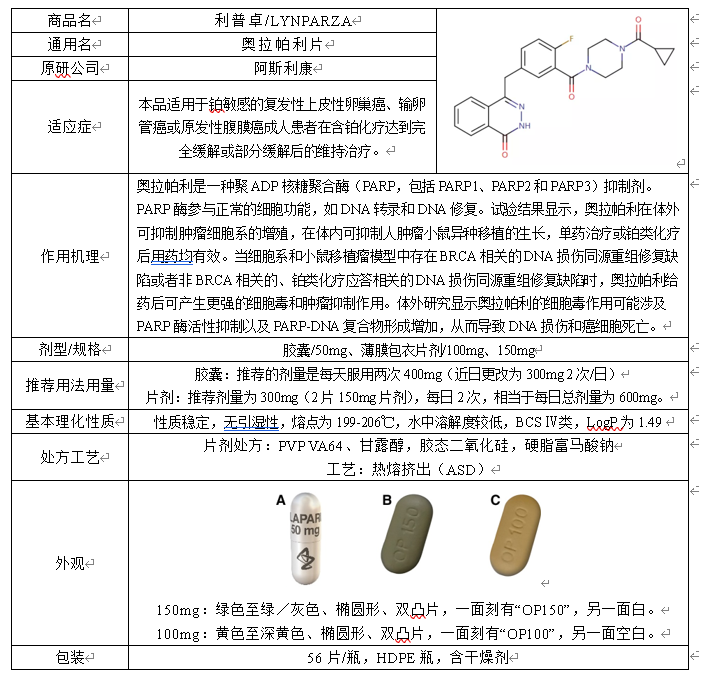
在“精准治疗”的号召之下,基因检测对乳腺癌治疗可以巨大的作用。在临床实践中,精准医疗追求针对每个病人正确选择和精确应用适宜的诊疗方法,实现医源性损害最小化、医疗耗费最低化以及病患获益最大化。奥拉帕利是一种聚ADP核糖聚合酶(PRAP)抑制剂,而PARP被抑制可引起细胞周期阻滞于G2/M期,最终诱导细胞凋亡。
奥拉帕利药物研发信息(部分,完整内容请登录“药融云数据库www.pharnexcloud.com/?mh”查看)
截图来源:药融云全球药物研发数据库
由于奥拉帕利难溶,需要先进的药物递送技术来确保生物利用度,最初批准的400mg剂量为八粒50mg胶囊,每日两次,而后开发了一种热熔挤出片剂处方(开发为固体分散体),以改善奥拉帕利的药代动力学和药效学特征,并减轻患者的给药负担。推荐的片剂剂量为300mg,每日两次(两片150mg片剂)。奥拉帕利基本信息,如下两表所示:
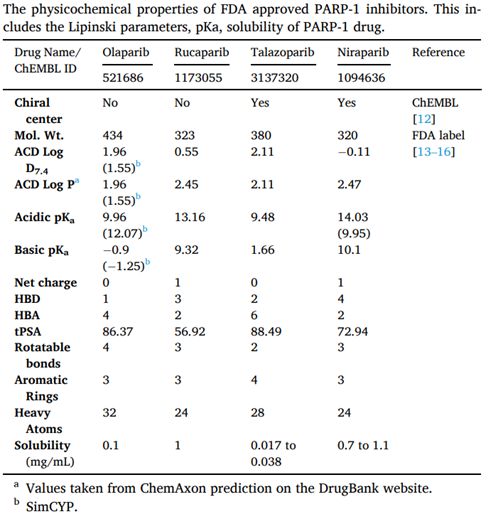
来源于参考文献3
一、胶囊和片剂制剂的体内PK
据药融云数据库显示,奥拉帕利首次于全球面世是在2014年底,伟胶囊剂。后为改善该产品的病人给药的顺应性,奥拉帕利2017年再次以片剂上市。截止目前,该药已在全球几百个国家获批,在市场上流通销售。
奥拉帕利上市时间轴(部分)
截图来源:药融云全球药物研发数据库
可是,给药400mg胶囊与300mg片剂,不同剂量的制剂在人体内并不等效,如下图所示:
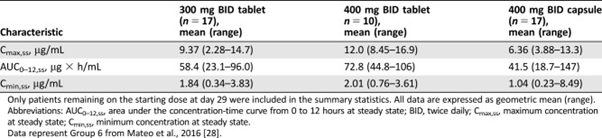
来源于参考文献2
本研究旨在比较奥拉帕利片剂与胶囊剂的PK,在生物利用度分析中,比较了晚期实体瘤患者的胶囊和片剂的PK特点。在片剂形式中,奥拉帕利被迅速吸收,给药后0.5至2h达到最大血浆浓度。重复片剂给药后,奥拉帕利300mg与奥拉帕利胶囊400mg剂量的稳定状态暴露相匹配或超过。由于相对吸收率和暴露率不同,片剂和胶囊的生物利用度不同。
二、胶囊和片剂制剂的安全性比较
300mg BID(一天两次)剂量的片剂(两片150mg片剂)、400mg BID剂量的片剂(两片150mg片剂和一片100mg片剂)和400mg BID剂量的胶囊(8粒50mg胶囊)安全性结果见下表。虽然片剂的MTD为400mg,但300mg剂量可减少AE(不良反应)和剂量减少,表明耐受性更好,这支持该剂量成为更理想的选择。
表2.BID片剂和胶囊治疗期间≥3级不良事件(发生在一名以上患者中)
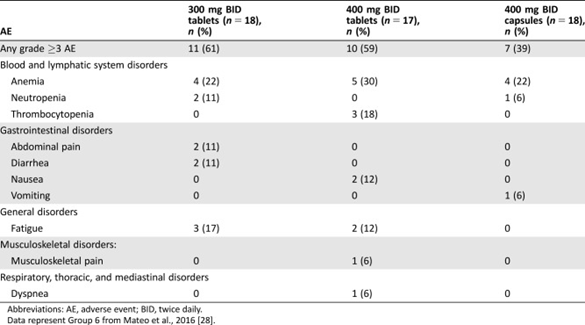
来源于参考文献2
三、胶囊和片剂制剂的有效性研究
本研究评估了患有OC的gBRCAm携带者的抗肿瘤活性。所有队列的ORR(客观缓解率)为30%,但接受300mg片剂给药的患者为38%,接受400mg的患者为42%。在其他疗效措施中,8周内肿瘤大小的百分比变化表明,与400mg的胶囊相比,两种片剂制剂剂量(300和400mg)的结果相似。在16周时观察到类似的结果,肿瘤缩小情况见下图。
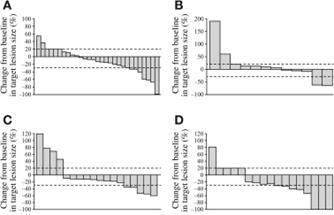
图1:16周时目标病变大小的百分比变化。(A):多次给药后,奥拉帕利胶囊400mg,每日两次(BID;n=29)。(B):多次给药200mg片剂BID后(n=13)。(C):多次给药300mg片剂BID后(n=18)。(D):多次给药400mg片剂BID(n=18)。来源于参考文献2
四、奥拉帕利片剂治疗的临床注意事项
300mg片剂剂量和400mg胶囊剂量的临床结果表明,没有证据表明片剂的益处风险状况有不利影响。事实上,片剂处方具有相似的疗效和安全性,给药负担更低;然而,重要的是要重申胶囊和片剂具有不同的生物利用度。因此,奥拉帕利片剂和胶囊不可互换,并且制剂不得在毫克到毫克转换的基础上被视为生物当量;不建议使用此类转换因子,并可能导致剂量不足或过量。尚未进行研究来调查将患者从奥拉帕利胶囊转换为片剂制剂的效果。因此,指导临床医生在将患者从胶囊过渡到片剂时使用推荐剂量。根据迄今为止的经验,患者总体上对从胶囊到片剂处方的过渡持积极态度。片剂的低给药负担对患者有吸引力,并没有等同于疗效降低。
已知当给药外观改变(即不同制造商的仿制药处方药以不同的尺寸、形状或颜色分配)时,患者的依从性会受到影响。当先前接受胶囊的患者为方便起见而接受片剂制剂时,从奥拉帕利胶囊到片剂的治疗变化可能对患者依从性产生类似的影响。重要的是要告诉患者,尽管他们每天服用的片剂较少,但他们仍在接受有效剂量的奥拉帕利。虽然服用奥拉帕利时进食会降低药物的峰值暴露并减慢其暴露速率,但不会改变患者的吸收程度;因此,在许多正在进行的奥拉帕利III期临床研究中,允许患者将片剂与小吃一起服用。食物对患者间PK的变异性没有影响。患者可能会有更大的满足感,以及与食物一起服用药物的便利性。
结论:
奥拉帕利片的开发是卵巢癌和乳腺癌治疗的重要一步,旨在减轻患者的给药负担,而不影响疗效或安全性。事实也表明了尽管奥拉帕利片剂与胶囊剂并不等效,但是片剂处方具有相似的疗效和安全性,给药负担更低,改善了病人的依从性。以前不了解的情况,猜想两种剂型所达到的目标应该等效,事实表明更应该关注这个新的产品能否达到安全性有效性的目的以及其临床优势(极大的改善了病人的给药顺应性)。
难溶性药物越来越多,已经成为了一种趋势,开发成增溶制剂,如上文中的奥拉帕利片剂使用了热熔挤出制备成了固体分散体,往往表明需要更多的资源和时间,当然,技术上开发的难度是显而易见。为了更快的验证其临床的安全性有效性,有的时候原研厂家就按照先开发成简单制剂的手段,先上临床,当然这样,就可能影响病人的顺应性,有极大的可能收到临床的投诉。但是,如何制定合适的开发策略以应对这一现实,是我们制剂开发人员不得不面对的现实。试想,做临床试验的同时,同步开展增溶技术的研究;当临床结果表明了未来能够开发上市的希望,增溶技术也开发成功,设计临床试验足以证明其安全性有效性的同时展现其改良后的临床价值,既提高了病人顺应性,又或许可能延长产品的生命周期,也不失为一种不错的办法。
文章很小,希望短短数语,可给予各位些许的启发,灵感,那将是不胜荣幸之事了。如果觉得有用,点个再看,那也是极好的!
参考文献:
1.利普卓(奥拉帕利片)的说明书
2.百度百科
3. Administration of the Tablet Formulation of Olaparib in Patients with Ovarian Cancer: Practical Guidance and Expectations
4. An overview of compound properties, multiparameter optimization, and computational drug design methods for PARP-1 inhibitor drugs
5.药融云数据库vip.pharnexcloud.com/?zmt-mh
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论