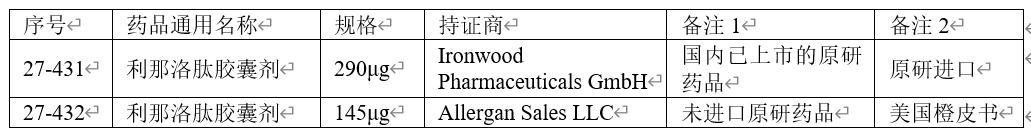
截至2025年1月,在国内,除原研进口(290µg)获批外,尚无其他原料药或制剂获准生产。目前利那洛肽原料药及制剂尚未收载于中国、欧美日药典。
国家药监局发布的仿制药参比制剂目录(第二十七批)收载的参比制剂信息如下:
二、国内申报情况
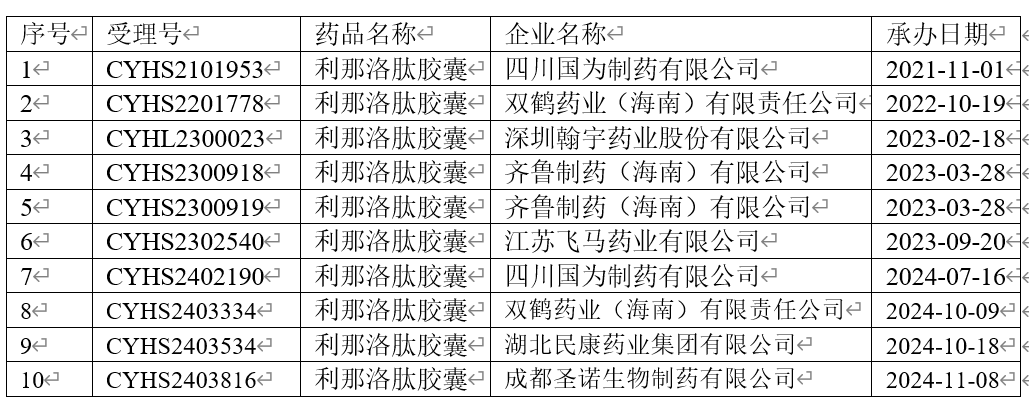
中国市场上除了原研进口产品外,无仿制产品获批。目前有10家企业按照新注册分类4类申报生产,目前均未获批。其中四川国为制药有限公司和双鹤药业(海南)有限责任公司在未被批准后,时隔两三年均进行了第二次申报生产。具体申报情况如下表所示:
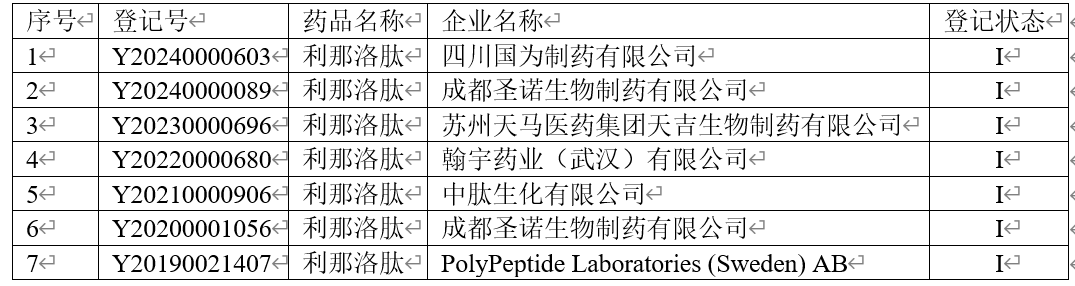
登记备案平台查询到利那洛肽原料药有6家企业申报,其中成都圣诺生物制药有限公司登记备案了2次,但状态均为I,即国内无获批原料药,其登记备案情况如下:
FDA个药指南《Draft Guidance on Linaclotide》中指出本品豁免BE的要求为:
1. API与参比制剂结构一致;
2. 处方种类及用量与参比制剂一致(Q1、Q2一致);
3. 体外溶出行为与参比制剂一致。
三、仿制难点
一般情况下,申请人根据FDA《Draft Guidance on Linaclotide》、ICH M9《基于生物药剂学分类系统的生物等效性豁免》等指导原则,在进行多项药学研究的基础上申请豁免生物等效性试验。说明书显示本品口服后极少进入体循环,ICH M9明确“基于BCS的生物等效性豁免仅适用于将药物输送至体循环的普通口服固体剂型或混悬剂型。”,故本品种可能不适用于按照BCS分类豁免BE研究。
本品在仿制上存在以下难点:
①是否能豁免BE有很多不确定性,受原料药结构等同性影响,同时也受处方Q1、Q2是否一致的影响;
②证明原料药等同性存在一定难度,尤其是如何设计试验证明其体外生物活性的一致性;
③原研处方专利保护期至2029年,故处方Q1、Q2可能难以保证一致性,给本品的BE豁免带来不确定性。
3.1 原料药结构等同性证明
证明利那洛肽原料药结构与参比制剂的等同性存在一定难度,FDA个药指南给出了相关建议,需满足以下3点:
①肽一级结构和相关分子特性,例如分子式、特定旋光度和光谱特征;
②3个二硫键的构型一致;
③体外生物活性一致(例如,结合,功能测定)。
前2条相对容易确证,对于第3条原料药体外生物活性的证明难以操作。体外生物活性细胞水平判定EC50或IC50在一定程度上存在批间差异,至于测定方法如何选择、样本量如何选择等均有待商榷,以上问题给利那洛肽原料药的获批带来难度,同时也给其胶囊的BE豁免带来很多不确定性。
3.2 Q1、Q2一致性
本品说明书公开了处方种类,即氯化钙二水合物、羟丙甲纤维素、L-亮氨酸和微晶纤维素,胶囊外壳的成分包括明胶和二氧化钛。Q1和Q2的一致性能否保证,原研制剂的处方有专利(专利号CN 102186490 B)保护,所以部分企业为了规避专利,对处方中部分辅料的用量进行调整,而FDA个药指南明确指出:如果要申请豁免BE,仿制产品的Q1和Q2需要与参比制剂保持一致。这种情况给本品的BE豁免有带来了一定的不确定性。
目前仅有江苏豪森一家申请临床试验,但却主动终止了临床试验。目前对于本品具体该如何处理,是否能豁免临床,监管要求仍不明朗,企业在立项时需谨慎考虑。
3.3 其他要求
FDA个药指南规定了本品溶出曲线的相关要求,具体要求如下:
仪器:美国药典(USP)第1法(篮法)
介质:水,0.1N HCl,pH 4.5 缓冲液和pH 6.8缓冲液
体积:500 mL
温度:37℃
转速:50 rpm
取样时间点10,15,20,30分
本品溶出曲线相似性要求很容易实现。
此外本品说明书有鼻饲管给药的相关描述,企业需按照《化学仿制药口服制剂经肠内营养管给药体外对比研究技术指导原则》的相关要求开展研究。
小结
目前,利那洛肽胶囊原研独占中国市场,市场潜力较大,很多厂家均申报了本品的仿制,但目前均未获批。该产品的仿制存在一定难度,企业在立项时需谨慎考虑,及时与监管机构沟通相关要求,在全国经济下行的趋势下,避免造成人力、物力、财力的浪费。
参考来源:
[1] FDA个药指南
[2] 日本IF文件
[3] 利那洛肽胶囊说明书
[4] 本品处方专利CN102186490B
想要解锁更多药品信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论