"仿制药"相关的结果
-

海正药业、扬子江药业、豪森药业围攻原研,19亿抗精神病药再迎仿制!
近日,石家庄四药有限公司的4类仿制药盐酸鲁拉西酮片的上市申请获CDE受理。据药融云数据显示,目前除原研住友制药外,2021年以来,已有3家企业(浙江海正、江苏豪森、扬子江),2种品规(40mg/20mg)的盐酸鲁拉西酮片仿制药获批。其中,浙江海正药业抢得了首仿。 -
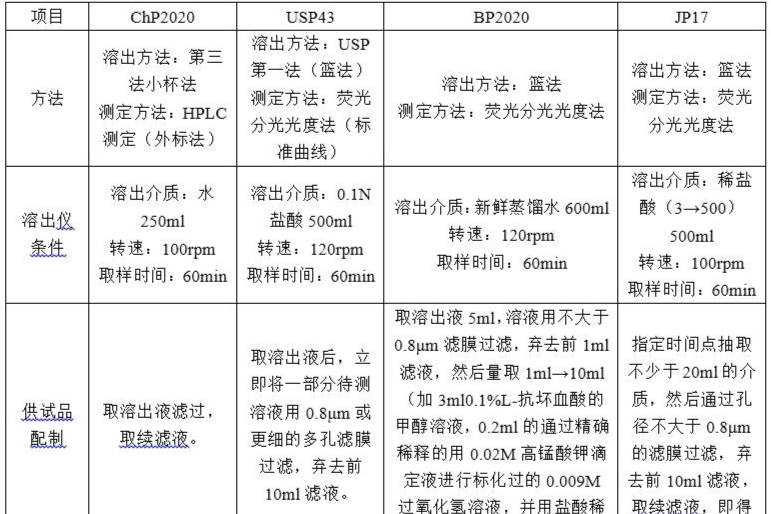
仿制药制剂质量标准研究过程
仿制药制剂质量标准研究过程,制剂的质量标准研究是仿制药开发最关键的一环,同时质量标准的研究贯穿于小试、中试、工艺验证、报批的全过程,现针对整个研发过程中制剂质量标准的研究阐述如下。 -
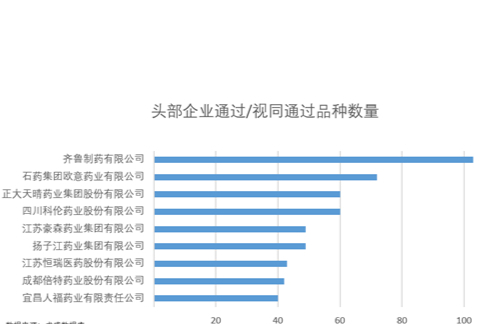
中小型化学仿制药生产企业的红海突围
药品上市许可持有人制度从2015年的摸着石头过河,到药品管理法2019年12月正式实施,以及配套文件的陆续出台,已经逐渐常态化。据不完全统计,截止2021年6月18日,化药委托生产业务相关生产许可证Bh证372家,Ch证215家。在药品上市许可持有人制度保障下,越来越多的传统化药生产企业、研发企业、经营企业正在充分密切合作,药品创新活力进一步激活。 -

集采杀价日,新药获批时!中国医药走到了仿制药or创新药的十字路口!
6月23日,第五批全国集采,在上海奉贤进行信息公开,据央视报道,本次集采品种数量多,撬动550亿药品市场;62个品种,205家企业参与;利伐沙班片20多家企业参选,最低约0.16元/片;酒石酸美托洛尔片最低约6分!降幅在90%以上药品不少! -

就“仿制药一致性评价中杂质研究的常见问题探讨”进行深度点评
《中国医药工业杂志》2021年第5期刊登了、由国家药品审评中心(CDE)赵娜和石靖两位老师撰写的“仿制药一致性评价中杂质研究的常见问题探讨”一文(文章详见文末图1-6)。又是一篇“集大成”的杂质研究文章,且由于是“裁判员”所著,故备受瞩目。本人打印出纸制版阅读数遍,深感CDE倡导的杂质研究已到无以复加程度,是时候“做减法”了。撷取10处点评,以飨众人。 -

仿制药BE结果是否确为临床等效的金标准?
我国是仿制药大国,目前为止,绝大多数药企仍为仿制药企业。仿制药是用于对原研药进行功能替代,并体现价格优势的替代品,其使命之一,是与原研药的疗效一致。倘若仿制药出现了异于原研药的疗效特征,有两种表现:无效(低效),或者不良反应。这两种问题的根源在哪里,BE试验的结果对于判断仿制药与原研药的等效,是否有绝对价值?笔者在此进行浅要论述。 -
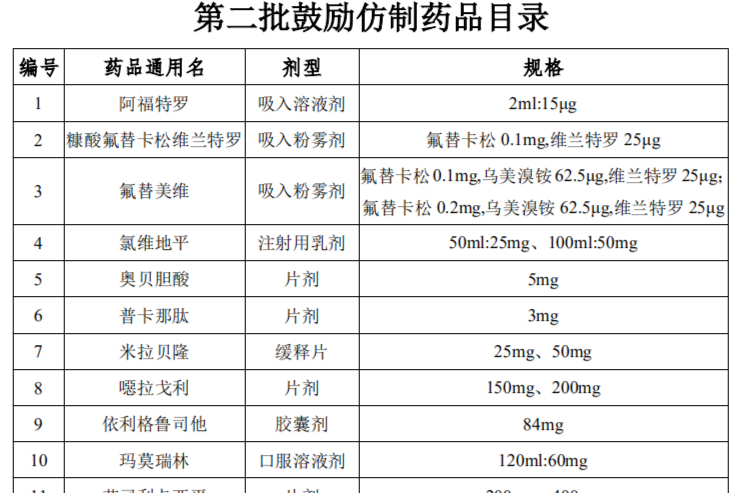
1周1次的胰岛素在华启动临床;头孢氨苄“大型团购”来了;Pre-IPO估值50亿的首药控股科创板IPO获受理
本周医药资讯一览:3款药物纳入拟优先审评品种公示;6款药物纳入拟突破性治疗品种公示;中国研发新冠治疗性抗体新药在欧美获批紧急使用;石药集团获抗IL-4Rα单抗CM310中国区独家权;以岭药业2021Q1净利润有望超7亿;复宏汉霖CD73抗体启动临床;诺和诺德一周一次长效胰岛素在中国启动临床;国家卫健委发布第二批鼓励仿制药品目录;十省(区、兵团)联盟带量采购头孢氨苄…… -

-
美国仿制药协会敦促 FDA 重新审视亚硝胺问题
普享药协会(AAM)于 10 月份发表了一份关于亚硝胺的白皮书,敦促 FDA 重新审视和重新评估药品中亚硝胺的安全性限度,同时还提出了一种“科学驱动的”基于风险的方法来评估药物中亚硝胺的潜在存在。 -

豪森药业卡博替尼首仿品种第二个上市申请获受理
10月30日,据CDE官网,豪森药业3类仿制药苹果酸卡博替尼片的第二个上市申请被CDE受理,这距该首仿品种首个上市申请被受理仅隔一个月左右。





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息