制剂的质量标准研究是仿制药开发最关键的一环,同时质量标准的研究贯穿于小试、中试、工艺验证、报批的全过程,现针对整个研发过程中制剂质量标准的研究阐述如下。
一、质量标准的生命周期 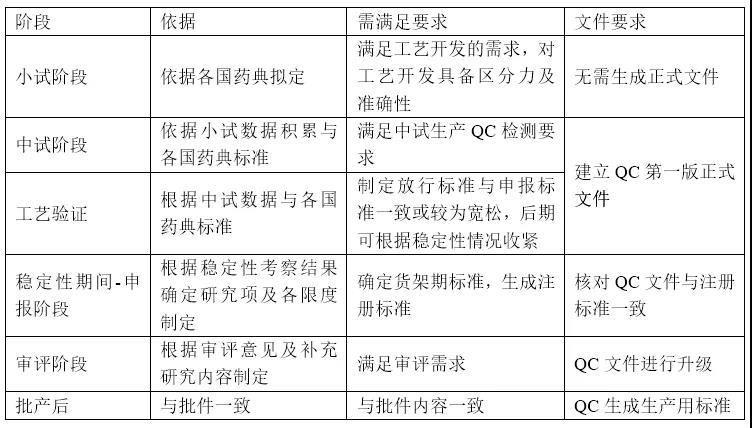
二、质量标准研究过程
1、 信息调研
首先查询各国最新药典、FDA、EMA审评报告、日本IF文件、进口注册标准查询品种的质量标准,并列表对比。在项目的初期拟定需要研究的成品质量标准。
具体实例1:某注射液,通过调研各国药典,在ChP、USP及BP均有收载,质量标准列表如下:
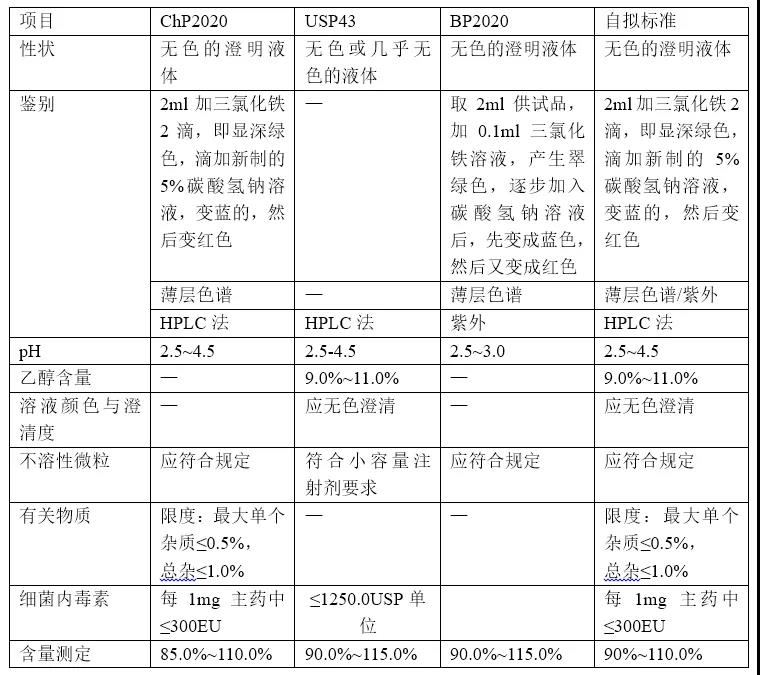
质量标准拟定依据:根据注射液一致性评价技术要点,制剂的质量标准应不低于各国药典标准,综合此品种各国药典所述,制定质量标准如上表所示。应注意pH值标准与制剂处方相关,因研究用参比制剂为美国上市,与欧洲上市的制剂处方略有不同,故此品种pH值的质量标准根据参比制剂的说明书制定。
2、 制定研究计划
根据拟定标准制定质量研究计划,计划应尽可能全,包括各国药典的标准项,并与项目研发进度相适应。
3、 小试阶段分析方法建立及方法学预验证
根据小试工艺开发的需求建立分析方法,此时建立方法的原则有:优选药典方法(中国药典及参比制剂上市国药典)或原料的检测方法;检测时间不宜过长,满足处方筛选需求。应进行预验证的方法有:片溶出曲线测定方法、含量测定方法、有关物质检测方法。
具体实例2:某小规格片剂溶出度检测方法各国药典对比如下:
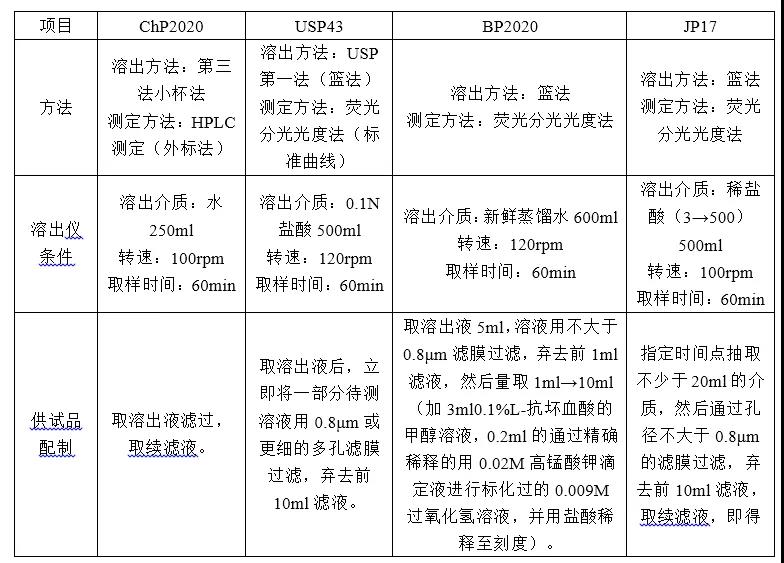
上述分析可知,除中国药典外,各国药典中溶出度的检测方法均为荧光分光光度法,思考原因应为规格小,荧光分光光度法检测灵敏度较高所致。又经文献查询,中国药典2005版此品种溶出度项下检测方法也是荧光分光法,但方法操作繁琐,重现性差,自2010年版药典开始,修改为小杯法及高效液相色谱法。因HPLC法较为普遍,重复性高,故考虑用HPLC法进行方法摸索。
溶出仪条件方面,各国药典均不一致,考虑参比制剂为美国上市,故前期方法建立时选择中国药典和美国药典方法进行对比研究。
另药典的供试品配制方法中,对过滤体积的要求有特殊规定,可能在酸性介质中滤膜吸附较严重,这些都需要在方法建立的过程中进行考量。
4、 中试阶段质量标准的建立
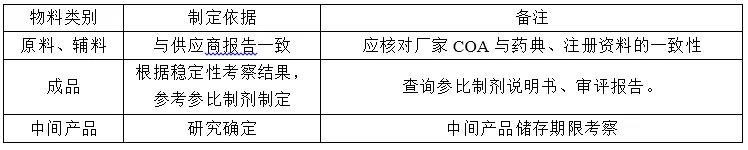
确立原料、辅料、包材、中间体、成品的质量标准。
- 原料标准:原料应尽可能选择登记状态为A的原料。质量标准一般与厂家标准一致,并满足制剂需求。片剂用原料应研究原料晶型、粒度,根据研究结果确定是否定入标准。用于注射剂用原料应规定细菌内毒素、重金属、微生物限度。
- 辅料标准:辅料选择原则为:有登记号为A的就选A的厂家,如为注射剂,有注射级应选择注射级。国产辅料的质量标准根据现行版药典制定,进口辅料综合进口登记标准、中国药典标准、所在国家的药典标准制定,一般选择最严原则;药用级辅料用于注射级应增订微生物及细菌内毒素控制。
- 包材标准:直接接触药品的包装材料和容器应符合国家药监局颁布的药包材标准。
- 中间产品:根据制剂工艺需求及成品的质量要求制定。
- 成品质量:根据各国药典及相关指导原则综合制定,检测方法优选药典方法,若制定新的检测方法,需证明新方法不劣于药典方法。
5、 分析方法学验证、确认与转移。
原辅料的方法学验证一般在中试之前完成,中间产品和成品的方法学验证一般在中试完成后用中试样品进行,并在工艺验证之前完成。此外,在研发单位完成方法学验证的分析方法需与生产企业进行方法转移。
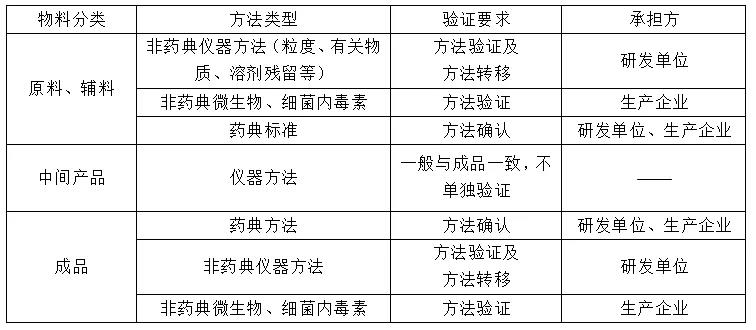
6、 质量标准文件生效
研发单位提供文件清单:原料、中间体、成品的质量标准、检验操作规程;辅料、包材的标准要求;分析方法验证报告。转移至生产企业,由生产企业生成相关质控文件。
7、 质量标准的升级
质量标准可能发生变更的三大节点:申报、发补、批准生产。务必在三大节点核对生产企业的文件与申报资料的一致性及时间逻辑的正确性。
8、关于储存条件和有效期
具体实例3:某片剂,参比制剂为美国橙皮书,国内有仿制药上市。中国药典和参比制剂说明书规定的储存条件如下:

美国药典的受控室温(controlled roomtemperature)为20~25℃或MKT值不超过25℃。
中国药典阴凉处指不超过20℃。鉴于美国药典和中国药典对温度的要求不同,如果参比制剂说明书规定储存条件为受控室温或不超过25℃,且申报者稳定性研究只提供了25℃的数据时, CDE一般会批准25℃以下保存,但是国内并无25℃以下的仓库,如此条件下,成品只能放在阴凉库了。所以如果制剂性质较稳定,建议此类品种可同时考察25℃和30℃两个长期条件,如果30℃稳定性没有问题,可按常温进行申报。
三、小结:
在制剂质量标准研究过程中,我们遵循的依然为国内外的各项相关指导原则,如:《ICHQ6A:质量标准:新原料药和新药制剂的检测方法和可接受标准》、《境外已上市境内未上市化学药品药学研究与评价技术要求》、《化学药品注射剂仿制药质量和疗效一致性评价技术要求》等。本文从研发思路及审评趋势的角度对仿制药制剂的质量标准研究过程做了相关总结,希望可以为广大制剂分析研究同行提供一些参考。






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论