《中国医药工业杂志》2021年第5期刊登了、由国家药品审评中心(CDE)赵娜和石靖两位老师撰写的“仿制药一致性评价中杂质研究的常见问题探讨”一文(文章详见文末图1-6)。又是一篇“集大成”的杂质研究文章,且由于是“裁判员”所著,故备受瞩目。本人打印出纸制版阅读数遍,深感CDE倡导的杂质研究已到无以复加程度,是时候“做减法”了。撷取10处点评,以飨众人。
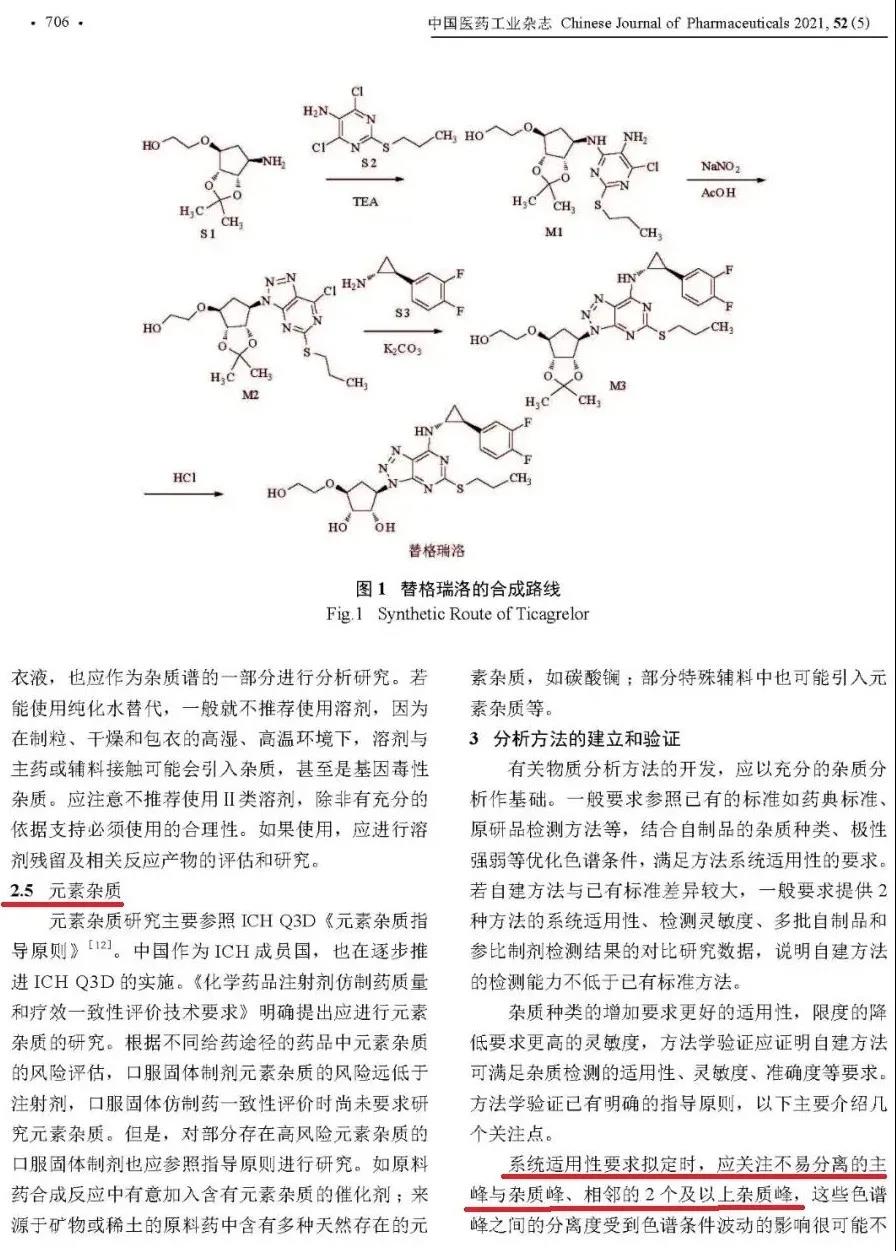
1.(图1)杂质是药品的关键质量属性,可能影响安全性和有效性。【杂质不会影响有效性,最多影响安全性。同时,不应使用“可能”一词,专业表达应避免副词。】
2.(图1)我们并不提倡杂质过度研究。【看来CDE也深知行业对该机构的诟病。】
3.(图2)根据影响因素、稳定性试验等考察结果,确定是否为降解杂质及加速降解条件,并与参比制剂进行杂质含量的比较…【影响因素系指高温、高湿、强光照射等剧烈条件,药品在生命周期不可能遭遇,故该条件下破坏出的杂质不会产生,这就是目前“研究了一大堆、采用准确法检测了一大堆,结果全是未检出”的现象根源。同时,无需开展影响因素条件下仿制药与原研药质量比对研究,因为该实验目的仅是洞察药品易受何条件影响,标注上今后加以规避即可。】
4.(图2)…,原则上该杂质含量不得大于参比制剂限度标准。【这是一个重大改变!请各位研发人员谨记运用。之前,CDE始终坚持“针对共有杂质,仿制药含量不得多于原研药”理念,为此本人曾在5年前撰文反驳(延伸阅读-2)。此番终于改为“可以多于,只要不过原研药质量标准限度值”,充分说明CDE这些年也在不断思考进步,颇感欣慰。】
5. (图2-3) 除了由起始物料引入外,还可能由光照下2位的手性碳构型翻转产生,因此在制剂中应进行这类异构体杂质的研究和控制。【“可能”一词充分说明疑神疑鬼、草木皆兵的心态。实际情况是、药品不可能被光照,因没人会把药品放在窗台爆嗮后再服用,所以,这个异构体不会翻转,杂质也不会产生、无需控制。】
6. (图3) 2.3 基因毒性杂质 【《ICH指导原则》于2000年推出。本人愈发感到:前10年真心指导居多,后10年时而参杂“烟雾弹”(延伸阅读-3),因为发达国家“为全世界人民服务”的初心动摇了。所以,我国作为发展中国家,一定要有取舍和独立自主的思考,否则会被忽悠瘸的。】
7. 理论上可能与胺类化合物如中间体M1中含有的二级胺结构,或……等引入的二级胺试剂等相互作用,存在产生相应亚硝胺类杂质的风险,故应参照相关指导原则进行风险评估和研究。【“理论上”、“风险”这类瞻前顾后、模棱两可的表述,充分说明CDE对杂质研究的认知已到难以自拔程度,如此、研究将永无止境。】
8. 另外,雷尼替丁制剂在存放过程中,尤其是在高于室温的环境下存放,随着时间延长,NDMA的含量可能逐渐增长至超过人体可接受水平。【不会有高于室温放置的情况发生,因为患者不会把药品放到烘箱里烘焙后再服用,因为运输和贮藏早已GSP。】
9. (图4)2.5 元素杂质【在下预测,《ICH指导原则》最终会忽悠到“空气中的灰”。】
10. 拟定系统适用性要求时,应关注不易分离的主峰与杂质峰、相邻的2个及以上杂质峰【杂质峰间可以不分离,因为此时计算结果将使含量错误偏高,是对自身的严格要求。所以,分析方法无需追求完美。专业的最高境界不是尽善尽美+谨小慎微,而是大开大合+收放自如。】
本人深谙:专业没有对错,只有谁拥有话语权;而每次选择,就是这位同仁、这家机构/公司、这个行业的宿命。之所以不厌其烦唠叨“别再过度研究杂质啦”,是因看到祖国制药业某种程度上的误入歧途,在下深感痛心疾首。期待转变的那一天早日到来!
图一:

图二:

图三:

图四:
图五:

图六:








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论