1.5.1 本周全球TOP10创新药研发进展
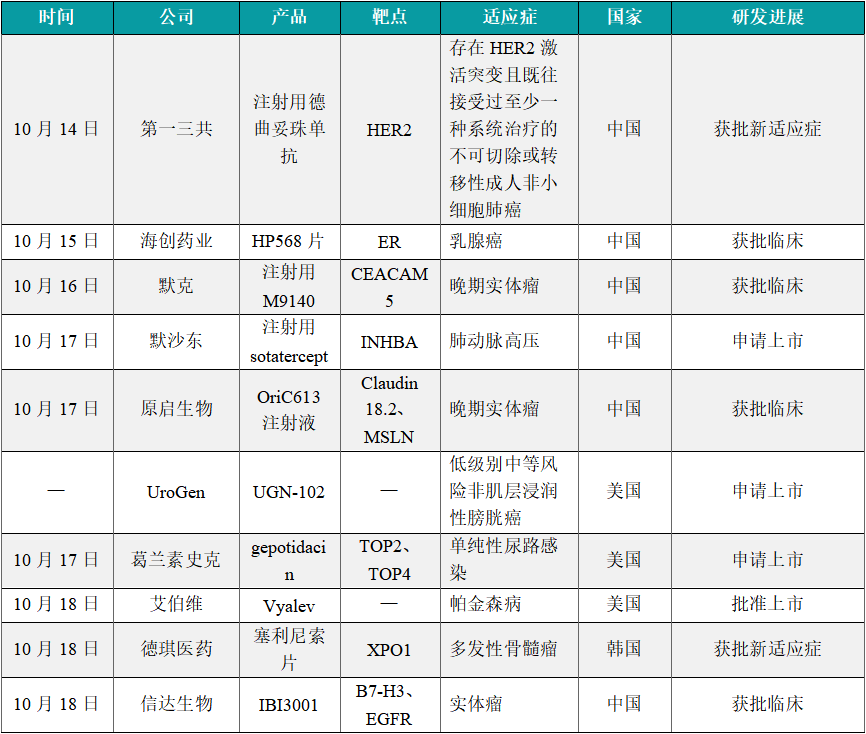
(1)第一三共ADC新药德曲妥珠单抗在中国获批肺癌新适应症
10月14日,中国国家药监局官网信息公示显示,由第一三共申报的注射用德曲妥珠单抗肺癌新适应症已经获得上市批准。根据早前优先审评信息公示,此次获批适应症为:用于治疗存在HER2激活突变且既往接受过至少一种系统治疗的不可切除或转移性成人非小细胞肺癌(NSCLC)患者。在中国,该产品此前已获批用于治疗HER2阳性和HER2低表达成人乳腺癌患者。此前曾多次被CDE纳入突破性治疗品种,适应症包括HER2阳性乳腺癌、HER2阳性胃或胃食管结合部腺癌、存在激活HER2突变的非小细胞肺癌等。2024年2月,德曲妥珠单抗用于治疗HER2激活突变的NSCLC的适应症上市申请获得CDE受理,并纳入优先审评。
(2)海创药业口服蛋白降解剂获批临床,针对乳腺癌
10月15日,海创药业宣布其1类新药HP568片在中国获得临床试验默示许可,拟开展用于治疗雌激素受体(ER)阳性和人表皮生长因子受体2(HER2)阴性的晚期乳腺癌(ER+/HER2-晚期乳腺癌)的临床试验。HP568是海创药业自主研发的靶向降解ERα的口服蛋白降解靶向嵌合体(Proteolysis Targeting Chimera,PROTAC)药物,由靶蛋白配体、E3连接酶配体和两配体间的连接子3部分构成,拟用于治疗ER+/HER2-晚期乳腺癌。
(3)德国默克ADC癌症新药在中国获批临床
10月16日,德国默克(Merck KGaA)申报的1类新药注射用M9140获得临床试验默示许可。根据公示,M9140是一款抗CEACAM5抗体偶联药物(ADC),具有拓扑异构酶1 (TOP1)抑制剂有效载荷exatecan。临床前研究表明,M9140可以与CEACAM5特异性结合,选择性杀伤靶阳性癌细胞。M9140还具有强大的旁观者效应,表明其具有治疗异质靶表达肿瘤的潜力。在两种基于maytansine的CEACAM5靶向ADC无效的CRC PDX模型中,基于TOP1抑制剂的ADC M9140具有很强的抗肿瘤功效,肿瘤体积减少74%和88%。本次在中国获批的是一项拟在中国晚期实体瘤受试者中开展的1期、开放性研究。
(4)默沙东肺动脉高压新药在中国申报上市
10月17日,默沙东申报的注射用sotatercept上市申请获得受理。公开资料显示,Sotatercept是一款IIA型激活素受体(ActRIIA)融合蛋白。它将ActRIIA经过改造的细胞外域与抗体的Fc端融合在一起,可以阻断激活素与细胞膜上的受体结合,从而降低激活素介导的信号传导。在临床前研究中,它可以逆转肺动脉壁和右心室的重塑。该产品也是默沙东于2021年以约115亿美元收购Acceleron Pharma公司获得的关键疗法。此前,sotatercept已获得FDA授予的突破性疗法认定,用于治疗肺动脉高压。
(5)原启生物双靶点CAR-T细胞疗法获批临床,治疗实体瘤
10月17日,原启生物1类新药OriC613注射液获批临床,拟开发治疗晚期实体瘤。根据原启生物新闻稿介绍,这是其自主研发的双靶点Claudin 18.2/MSLN自体CAR-T细胞治疗药物。OriC613采用“AND”逻辑门控设计,通过拆分二代CAR结构元件,使OriC613 CAR-T细胞表面并联表达针对MSLN和CLDN18.2的嵌合抗原受体,且仅对同时表达两个抗原的肿瘤细胞产生响应,增加肿瘤靶向杀伤活性的同时,能够降低非肿瘤靶向毒性(OTOT),从而提高临床安全性。这种创新性设计旨在解决实体瘤癌症药物的关键挑战,选择性杀死肿瘤细胞的同时有效保护了正常健康细胞。
(6)UroGen在研疗法UGN-102治疗非肌层浸润性膀胱癌在美国提交上市申请
近日,UroGen Pharma宣布美国FDA已接受其在研疗法UGN-102膀胱内灌注液的新药申请,用于治疗低级别中等风险非肌层浸润性膀胱癌(LG-IR-NMIBC)患者。UGN-102膀胱灌注液是一种创新的丝裂霉素(mitomycin)药物。该疗法利用UroGen专有的RTGel技术,这种基于水凝胶的持续释放制剂可使膀胱组织能够更长时间地暴露于丝裂霉素之下,从而通过非手术手段治疗肿瘤。FDA预计在2025年6月13日以前公布审评结果。根据新闻稿,如果获批,UGN-102将成为美国FDA批准用于治疗LG-IR-NMIBC患者的首款药物。
(7)葛兰素史克口服抗生素gepotidacin在美国提交上市申请
10月17日,葛兰素史克宣布美国FDA已接受其潜在"first-in-class"口服抗生素gepotidacin的新药申请(NDA),用于治疗患有单纯性尿路感染(uUTI,也称为急性膀胱炎)成年或青少年(≥12岁)女性患者,患者体重须≥40公斤。Gepotidacin是一款具有全新作用机制的抗生素,它可以口服,并具有双重作用机制,能同时选择性地结合并抑制DNA促旋酶和DNA拓扑异构酶IV,从而诱发在复制进程的DNA发生单链断裂,进而达到杀死病原体的目的。FDA授予该申请优先审评资格,并预计在2025年3月26日前完成审评。根据新闻稿,若获批,gepotidacin将成为20多年来首个用于治疗uUTI的新型口服抗生素药物。
(8)艾伯维帕金森疗法Vyalev获美国批准上市
10月18日,艾伯维宣布,美国FDA已批准Vyalev(foscarbidopa和foslevodopa)上市,用于治疗晚期帕金森病(PD)成人患者的运动能力波动。Vyalev是左旋多巴和卡比多巴的前体药物。它们具有很高的水溶性,可以通过一个连接到皮下的泵持续皮下输注给药,从而稳定维持药物在体内的浓度。新闻稿指出,这是FDA批准的首款基于左旋多巴的皮下24小时持续输注疗法。
(9)德琪医药抗癌药塞利尼索在韩国获批新适应症
10月18日,德琪医药宣布,韩国食品医药品安全部已批准塞利尼索片的补充新药上市申请(sNDA),联合硼替佐米和地塞米松用于治疗至少接受过一种先前治疗的多发性骨髓瘤(MM)成人患者。塞利尼索片是一款全新机制的口服选择性核输出蛋白(XPO1)抑制剂。通过抑制核输出蛋白XPO1,该产品可促使肿瘤抑制蛋白和其他生长调节蛋白的核内储留和活化,并下调细胞浆内多种致癌蛋白水平。此前,塞利尼索片已在韩国获批联合地塞米松用于治疗复发/难治性多发性骨髓瘤(R/R MM)和单药治疗复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)两项适应症。本次是该产品在韩国获批的第三项适应症。
(10)信达生物双抗ADC癌症新药在中国获批临床
10月18日,信达生物1类新药IBI3001获得临床试验默示许可,拟开发治疗实体瘤。公开资料显示,IBI3001是一款糖基化定点偶联、针对B7-H3和EGFR的双特异性抗体偶联药物(ADC)。本次为该产品首次在中国获批IND。研究表明,IBI3001具有多重抗肿瘤的机制,包括增强的EGFR信号阻断、EGFR与B7-H3介导的药物内吞与细胞杀伤、强效的ADC旁观效应。此外,优化后的B7-H3臂不仅增强了EGFR信号通路阻断效果,还降低了EGFR靶向毒性。IBI3001对多种实体肿瘤细胞均显示出较好的体外细胞毒性。
1.5.2本周全球TOP10积极/失败临床结果
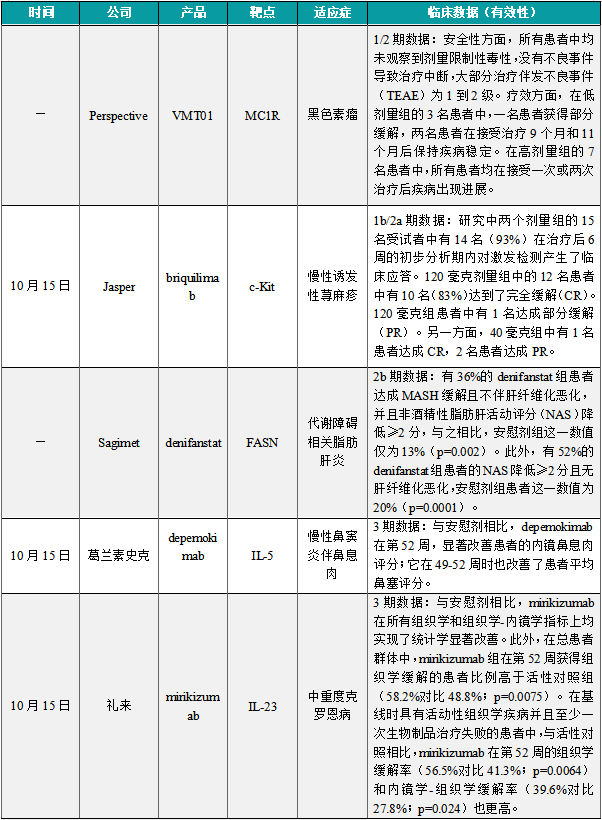

(1)Perspective靶向MC1R核药疗法1/2期临床结果公布
近日,Perspective Therapeutics公司公布了在研潜在“first-in-class”核药疗法VMT01的1/2期临床试验的最新结果。试验结果显示,在接受低剂量VMT01治疗的黑色素瘤患者中观察到持久的无进展生存期。该公司将进一步探索更低剂量的VMT01作为单药,或与抗PD-1抗体联用,在肿瘤微环境中的免疫刺激活性。VMT01是一款靶向MC1R的核药疗法,使用同位素铅释放α粒子。在临床前研究中这一疗法具有两种不同的作用机制,在高剂量下可直接杀死细胞,在低剂量下可通过免疫刺激诱导免疫介导的细胞死亡,并且这一效果可被免疫检查点抑制剂增强。
(2)Jasper的briquilimab单抗1b/2a期结果积极,超90%荨麻疹患者达成缓解
10月15日,Jasper Therapeutics公布其进行中SPOTLIGHT临床1b/2a期研究的初步数据。Briquilimab是一种非糖基化单克隆抗体,可通过靶向细胞表面受体c-Kit(也称为CD117)以避免与干细胞因子结合,从而阻断肥大细胞中的关键生存信号,造成细胞凋亡与耗竭,从而消除肥大细胞驱动疾病(如慢性荨麻疹)中炎症反应的潜在来源。分析显示,研究中两个剂量组的15名受试者中有14名(93%)在治疗后6周的初步分析期内对激发检测产生了临床应答。120毫克剂量组中的12名患者中有10名(83%)达到了完全缓解(CR)。120毫克组患者中有1名达成部分缓解(PR)。另一方面,40毫克组中有1名患者达成CR,2名患者达成PR。
(3)Sagimet在研疗法denifanstat治疗代谢障碍相关脂肪性肝炎2b期结果积极
近日,Sagimet Biosciences公司宣布,在研疗法denifanstat治疗代谢障碍相关脂肪性肝炎(MASH)的2b期临床试验FASCINATE-2的结果在《柳叶刀》子刊The Lancet Gastroenterology & Hepatology上发表。报告显示,denifanstat在第52周与安慰剂相比,在两个主要临床终点上均显示出显著改善。有36%的denifanstat组患者达成MASH缓解且不伴肝纤维化恶化,并且非酒精性脂肪肝活动评分(NAS)降低≥2分,与之相比,安慰剂组这一数值仅为13%(p=0.002)。此外,有52%的denifanstat组患者的NAS降低≥2分且无肝纤维化恶化,安慰剂组患者这一数值为20%(p=0.0001)。
(4)葛兰素史克超长效抗体疗法depemokimab治疗慢性鼻窦炎伴鼻息肉3期临床达主要终点
10月15日,葛兰素史克宣布在研超长效抗体疗法depemokimab在治疗慢性鼻窦炎伴鼻息肉(CRSwNP)患者的两项3期临床试验ANCHOR-1和ANCHOR-2中达到主要终点,与安慰剂相比,depemokimab在第52周,显著改善患者的内镜鼻息肉评分;它在49-52周时也改善了患者平均鼻塞评分。两组患者均接受背景标准治疗。新闻稿指出,depemokimab是首款在3期临床试验中用于治疗CRSwNP的超长效生物制品疗法,它具有延长的半衰期,与IL-5强力结合,只需患者每6个月接受一次治疗。IL-5在鼻息肉组织中高度表达,是介导2型炎症的关键细胞因子之一。
(5)礼来抗IL-23抗体治疗克罗恩病3期结果积极
10月15日,礼来公司宣布了IL-23抗体mirikizumab治疗中重度克罗恩病患者的3期临床试验VIVID-1的积极结果。试验结果显示,与安慰剂相比,mirikizumab在所有组织学和组织学-内镜学指标上均实现了统计学显著改善。此外,在总患者群体中,mirikizumab组在第52周获得组织学缓解的患者比例高于活性对照组(58.2%对比48.8%;p=0.0075)。在基线时具有活动性组织学疾病并且至少一次生物制品治疗失败的患者中,与活性对照相比,mirikizumab在第52周的组织学缓解率(56.5%对比41.3%;p=0.0064)和内镜学-组织学缓解率(39.6%对比27.8%;p=0.024)也更高。
(6)强生nipocalimab疗法治疗AChR靶向抗体阳性全身性重症肌无力青少年2/3期结果积极
10月16日,强生宣布临床2/3期Vibrance-MG研究获得积极结果。其在研新生儿Fc受体(FcRn)靶向抗体疗法nipocalimab联合标准疗法(SOC),用于治疗AChR靶向抗体阳性全身性重症肌无力(gMG)青少年(12-17岁)患者时实现了持续的疾病控制。分析显示,nipocalimab联合SOC治疗达到研究的主要终点,即患者的总血清IgG减少(69%),以及两项次要终点,即患者日常生活活动(MG-ADL)评分和定量重症肌无力(QMG)评分,这是疾病活动的指标。
(7)Jazz小分子联合疗法显著延长广泛期小细胞肺癌患者生命
10月16日,Jazz Pharmaceuticals宣布IMforte临床3期试验的积极顶线结果,该试验评估Zepzelca(lurbinectedin)与PD-L1抑制剂Tecentriq(atezolizumab)联合作为广泛期小细胞肺癌(ES-SCLC)成人患者(≥18岁)一线维持疗法的效果。分析显示,该研究达成主要终点。Zepzelca和Tecentriq联合疗法与Tecentriq单药相比,在总生存期(OS)和无进展生存期(PFS)表现出统计学上显著改善。
(8)Beacon基因疗法AGTC-501治疗X连锁视网膜色素变性2期结果积极
10月16日,Beacon Therapeutics公司宣布,在研基因疗法AGTC-501在治疗X连锁视网膜色素变性(XLRP)的2期临床试验SKYLINE中获得积极结果。AGTC-501是Beacon的主打项目,正在进行治疗XLRP的注册性临床试验。XLRP是一种遗传性单基因隐性疾病,会导致男孩和年轻男性视力逐渐丧失。XLRP主要由视网膜色素变性GTPase调节剂(RPGR)基因突变引起。AGTC-501表达全长RPGR蛋白,从而解决XLRP引起的感光细胞损伤,包括视杆细胞和视锥细胞的丧失。在接受治疗24个月后,接受高剂量AGTC-501治疗的眼睛的缓解率达到57%。接受低剂量AGTC-501治疗的眼睛的缓解率为25%。AGTC-501表现出良好的安全性和耐受性,治疗伴发不良事件的大多为轻度或中度。
(9)默沙东肺炎球菌疫苗3期临床结果积极
10月17日,默沙东公司公布了3期临床试验STRIDE-8的结果。该试验评估了Capvaxive(21价肺炎球菌结合疫苗)与活性对照疫苗组合(15价肺炎球菌结合疫苗PCV15联合23价疫苗PPSV23)在有特定慢性疾病、且易感肺炎球菌疾病的18至64岁无疫苗接种史成人中的免疫原性、安全性和耐受性。STRIDE-8试验的主要发现包括:在接种疫苗30天后,Capvaxive对疫苗包含的所有21种血清型均激发免疫原性。Capvaxive激发的免疫反应在13种与活性对照疫苗组合共享的血清型方面与活性对照组相当,而在Capvaxive独有的8种血清型方面免疫反应更高。Capvaxive组中参与者的不良事件(AEs)发生率,包括注射部位、全身性和疫苗相关的不良事件,均在数值上低于活性对照组。
(10)百时美施贵宝PD-1抑制剂Oppo联合疗法治疗晚期经典型霍奇金淋巴瘤3期结果积极
近日,百时美施贵宝公司的重磅PD-1抑制剂Oppo(nivolumab)与化疗联用,一线治疗晚期经典型霍奇金淋巴瘤患者的3期临床试验结果。数据显示,在中位随访时间为2.1年时,Oppo组合疗法与活性对照组相比,将患者疾病进展或死亡风险降低55%(HR=0.45,95% CI,0.30-0.65)。Oppo组的2年无进展生存率为92%,活性对照组这一数值为83%。在总生存率方面,Oppo组的2年总生存率达到99%,7名患者死亡,活性对照组的2年总生存率为98%,14名患者死亡。Oppo组合疗法将患者死亡风险降低61%(HR=0.39,95% CI,0.15-1.03)。这些数据支持FDA批准Oppo组合疗法作为一线疗法治疗此类患者。
同期事件:
1. 2024年第42周10.14-10.20国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第42周10.14-10.20国内仿制药/生物类似物申报/审批数据分析
3. 2024年第42周10.14-10.20国内医药大健康行业政策法规汇总
4. 2024年第42周10.14-10.20全球医药大健康行业投融资数据
以上内容均来自{药融云医药行业观察周报(2024.10.14-2024.10.20)},如需查看或下载完整版报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论