
4月17日,Gamida Cell宣布FDA已批准公司“现货型”同种异体干细胞疗法Omisirge ®(omidubicel-onlv),用于患有血癌的12岁及以上的成人和儿童患者。受到此消息影响,Gamida Cell的股价大幅上涨近40%,目前市值0.913亿美元。
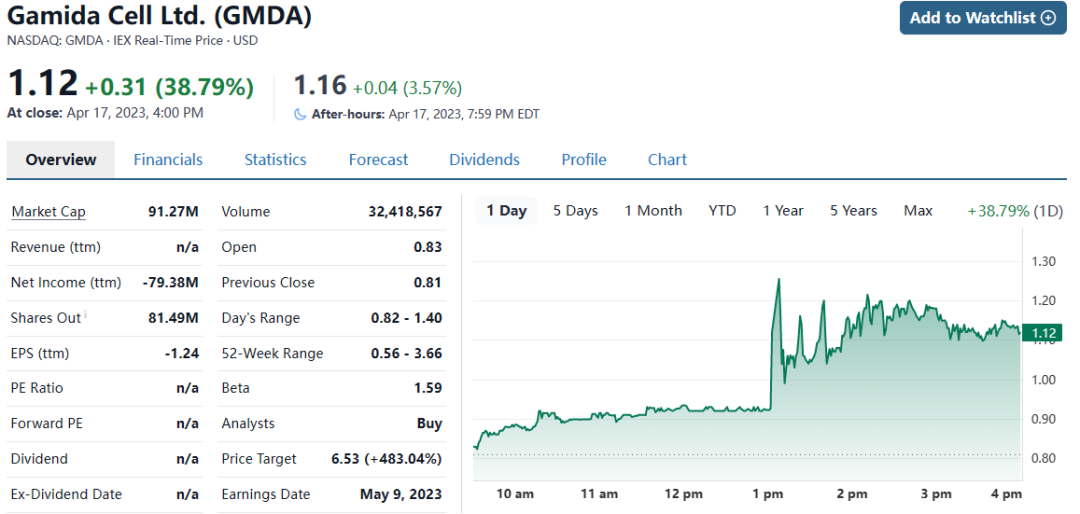
2022年财报显示,Gamida Cell的研发费用支出4269万美元,截止去年底,公司在手现金及等价物6465万美元,去年净利润亏损7940万美元。该同种异体干细胞疗法为公司首个获批产品,上市后或将改善公司现金状况。

来源:Gamida Cell 2022年财报
一、关于Omisirge
Omisirge是一种经过大幅改良的同种异体干细胞疗法,同时也是一种造血干细胞疗法,用于加快体内中性粒细胞(白细胞亚群)的恢复,并降低感染风险。这也是第一个在全球随机3期临床研究的基础上获得批准的同种异体干细胞移植疗法。
Omisirge药物研发信息(部分,完整内容欢迎登陆“摩熵医药(原药融云)数据库www.pharnexcloud.com/?mh”查看)
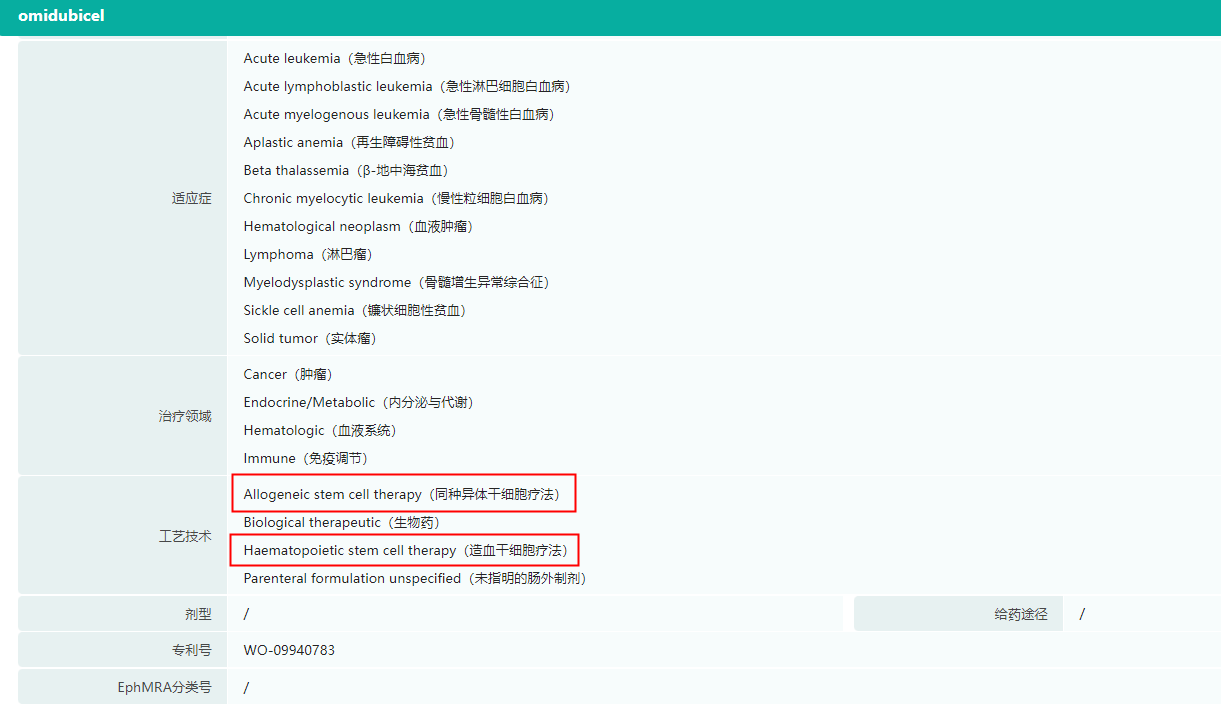
截图来源:药融云全球药物研发数据库
据摩熵医药(原药融云)数据库显示,此前Omisirge还获得了美国FDA认证的多项突破性疗法、孤儿药以及优先审评的特殊审批,反映出干细胞移植对额外供体来源的需求未得到满足。除此次获批的血癌外,Gamida Cell还在同一时间向FDA递交了Omisirge针对急性淋巴细胞白血病、急性白血病、急性骨髓性白血病、骨髓增生异常综合征、慢性粒细胞白血病、淋巴瘤适应性的上市申请。
Omisirge特殊审批认证情况
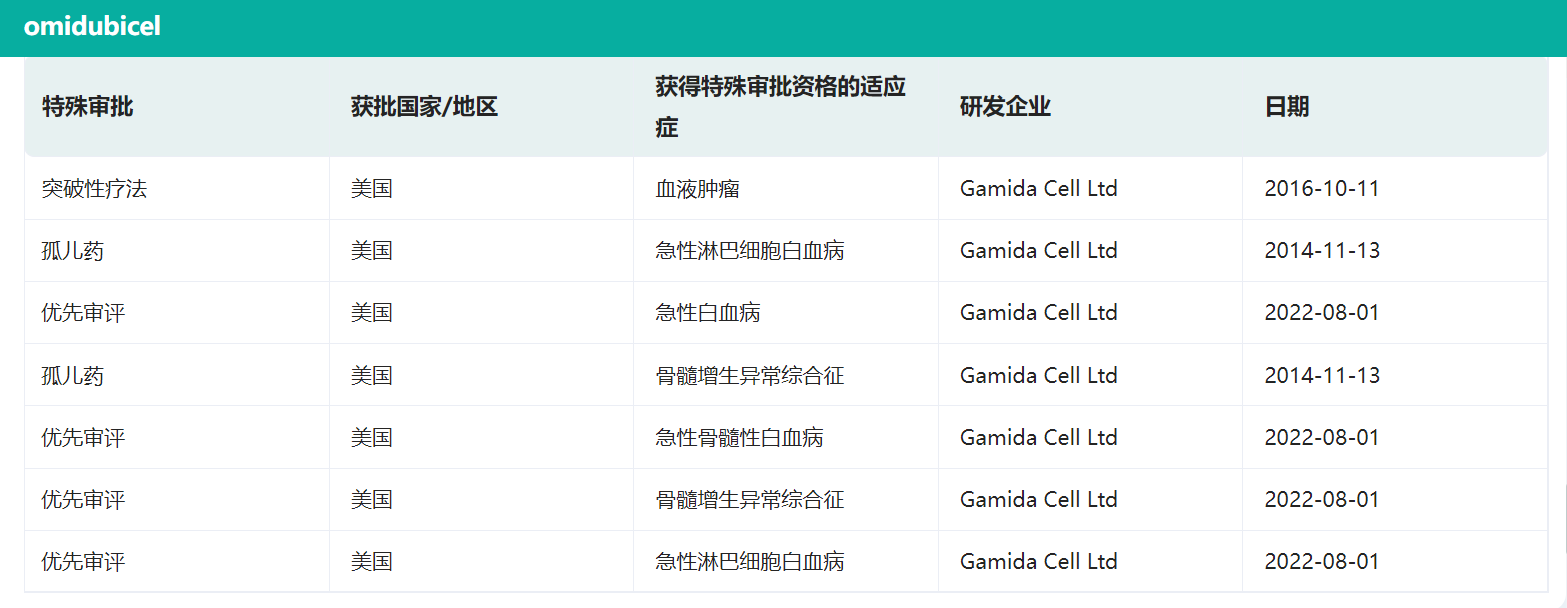
截图来源:药融云全球药物研发数据库
Omisirge的安全性和有效性获得一项随机、多中心试验的支持,该试验比较了在12岁至65岁之间受试者中,Omisirge移植与一般脐带血移植在避免移植感染的效力。试验共招募了125名血癌确诊患者。Omisirge显示在治疗对象中,中性粒细胞恢复的中位时间为12天,而标准脐带血为22天(p<0.001)。在移植后100天内,Omisirge组有39%的患者发生2/3级细菌或3级真菌感染,标准脐带血组则有60%。Omisirge的安全状况符合异体造血干细胞移植的预期不良事件。
Gamida Cell总裁兼首席执行官Abbey Jenkins表示:"FDA批准Omisirge是治疗血液恶性肿瘤患者的重大进展,我们相信这可能会增加干细胞移植的机会,并有助于改善患者的治疗效果。"我们感谢所有的临床医生、患者和整个Gamida Cell团队,没有他们,就不可能有这次批准。我们也感谢美国食品和药物管理局在支持Omisirge和其他针对癌症和其他严重疾病患者的创新和可能拯救生命的细胞疗法的发展方面所发挥的关键作用。"
二、关于Gamida Cell
Gamida Cell是细胞疗法的先驱,致力于将细胞转化为强大的疗法。该公司专有的烟酰胺(NAM)技术利用NAM的特性来增强和扩展细胞,创造出可能治愈血液系统恶性肿瘤患者的同种异体细胞治疗产品和候选药物。其中包括Omisirge®,一种FDA批准的烟酰胺修饰的同种异体干细胞疗法,以及GDA-201,一种正在研究用于治疗血液系统恶性肿瘤的内在NK细胞疗法候选药物。
Gamida Cell产品管线
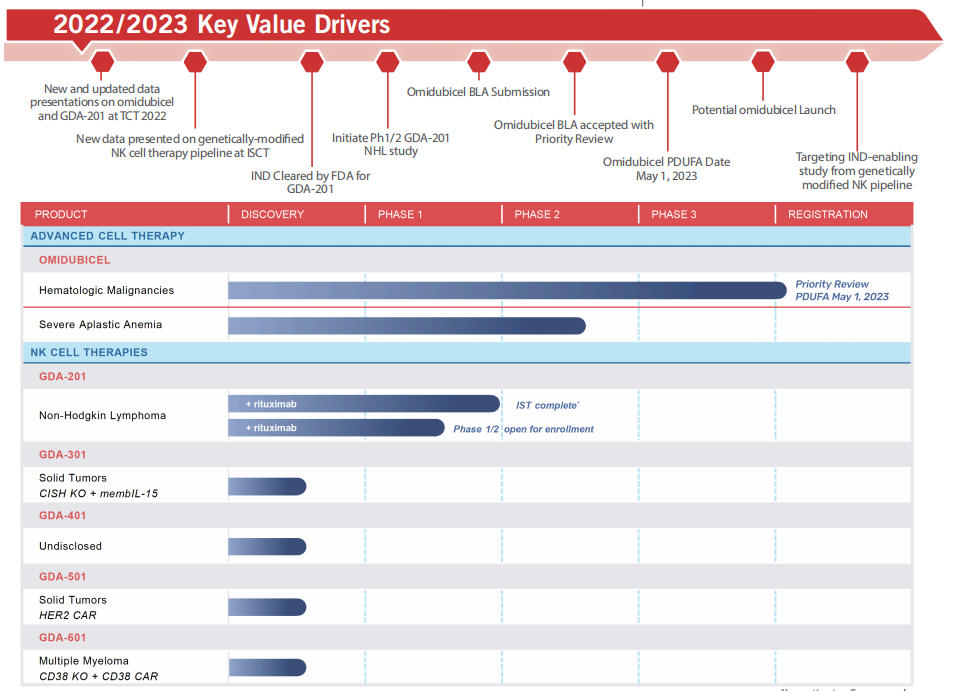
来源:Gamida Cell官网
参考来源:
[1] 摩熵医药(原药融云)数据库
[2] Gamida Cell官网
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论