
生物医药全产业链数据服务平台
掌上数据


打开微信扫一扫
产品矩阵

摩熵数科产品矩阵
查看详情数据产品(4大产业链架构)
服务产品(4大核心服务)
其他产品
全行业专利数据查询平台
全方位医学文献查询平台
"CDE"相关的结果
-
药物创新是大势,儿童用药需关注,政策来了别错过
CDE官网改版已经一月有余,相比于旧版,新版CDE网站使用更方便,模块更清晰。近期,CDE新闻中心也发布了一系列不得不看的新闻。那都有哪些重点呢?小编针对部分新闻做了梳理和总结,详情见下。 -

BE豁免,CDE再发重磅新规!4个实例教你做BE豁免!征求意见稿二!
原国家食品药品监督管理总局于2016年3月发布了《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》,规定多规格口服固体制剂可以基于其中某一规格的人体生物等效性试验结果,采用体外药学评价的方法豁免其他规格人体生物等效性研究,其中,豁免条件之一为“各规格制剂的处方比例相似”。 -

CDE征求:CAR-T指导原则意见!!
嵌合抗原受体T细胞治疗产品具有新颖性、复杂性和技术特异性的特点,随着此类产品的研发进展和陆续申报上市,为促进企业及早发现此类产品的风险,提供有效地风险最小措施,确保上市后安全性风险可控,有必要对申报上市的临床风险管理计划提出要求和提供指导。我中心在充分调研的基础上起草了《嵌合抗原受体T细胞(CAR-T)产品申报上市临床风险管理计划技术指导原则(征求意见稿)》。CDE200303年前 -
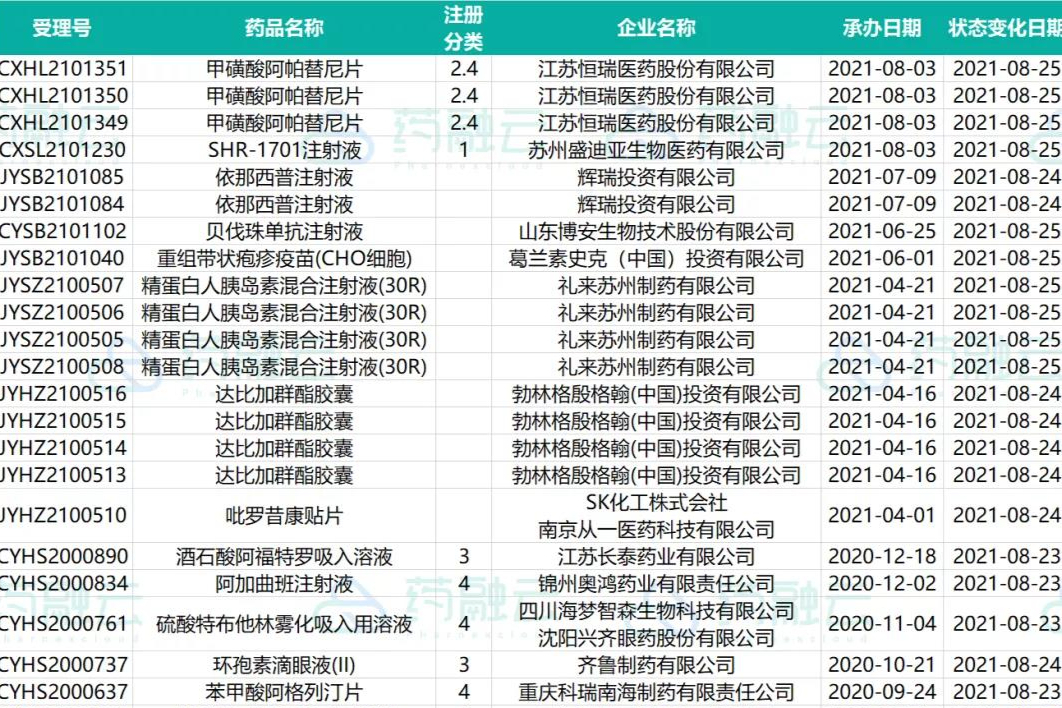
CDE药审新动态!9款创新药申请临床!舒泰神STSA-1002国内首报IND、恒瑞、德琪医药...
2021年8月20日至8月26日期间,共有12个品种通过(含视同通过)一致性评价。有华北制药「注射用阿莫西林钠克拉维酸钾」和湖北舒邦药业「尼美舒利分散片」2款首仿获批上市 -

CDE公开征求《境外生产药品上市后备案类变更办理程序和要求(征求意见稿)》意见
根据《药品上市后变更管理办法(试行)》(2021年第8号),为明确境外生产药品上市后备案类变更办理程序和要求,我中心研究制定了《境外生产药品上市后备案类变更办理程序和要求》,经请示国家局,现在中心网站予以公示。 -

刚刚!CDE再发4条临床指导原则!7月已发6条临床相关!
刚刚!CDE再发4条临床指导原则!7月已发6条临床相关! 关于公开征求《生物类似药临床药理学研究技术指导原则(征求意见稿)》意见的通知 关于公开征求《肾功能不全患者的药代动力学研究技术指导原则(征求意见稿)》意见的通知 -
CDE新公示临床试验共计56项,涉及罗氏、恒瑞、君实等32款新药
2021年5月17日-5月23日,CDE新公示临床试验共计56项。从药品类型来看,化学药物共计43项,生物制品12项,中药/天然药物1项。 -

-

百时美施贵宝血液病创新药Luspatercept上市申请获CDE优先审评
百时美施贵宝血液病创新药Luspatercept上市申请获CDE优先审评 -

微芯生物西奥罗尼治疗SCLC关键性Ⅲ期临床试验申请获受理
近日,深圳微芯生物科技股份有限公司递交的用于治疗经过2线系统化疗方案后疾病进展或复发的小细胞肺癌(SCLC)的国家1类原创新药西奥罗尼(Chiauranib)关键性Ⅲ期临床试验申请(IND)获国家药品监督管理局药品审评中心(CDE)受理(受理号:CXHL2100009国)。




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息