一、本周药品审评审批进展要点
- 药审中心受理总量为253个,涉及品种185个
- 9个1类新药申请临床获CDE受理
- 新增16个按仿制药质量和疗效一致性评价品种申报的受理号
- 12个品种通过(含视同通过)一致性评价,2款首家过评
- 舒泰神北京公司自主研发的STSA-1002国内首报IND
- 公众号回复CDE受理20210829,获取本周CDE受理品种信息
数据统计时间段为2021年8月20日-2021年8月26日,药融云将定期公示药品审评审批信息,关注我们即可定期查看。如有疏漏,欢迎指正!
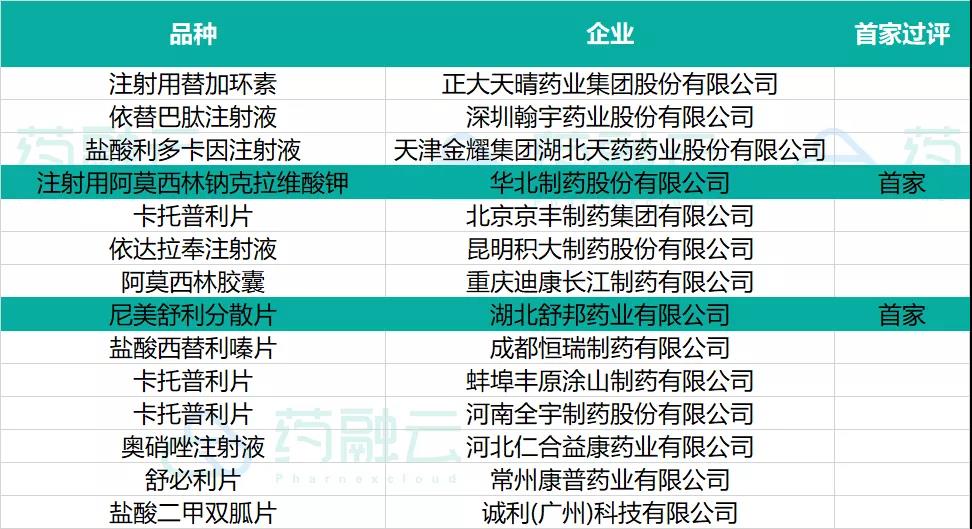
2021年8月20日至8月26日期间,共有12个品种通过(含视同通过)一致性评价。有华北制药「注射用阿莫西林钠克拉维酸钾」和湖北舒邦药业「尼美舒利分散片」2款首仿获批上市,具体信息如下:
过评品种信息
二、在审评审批阶段
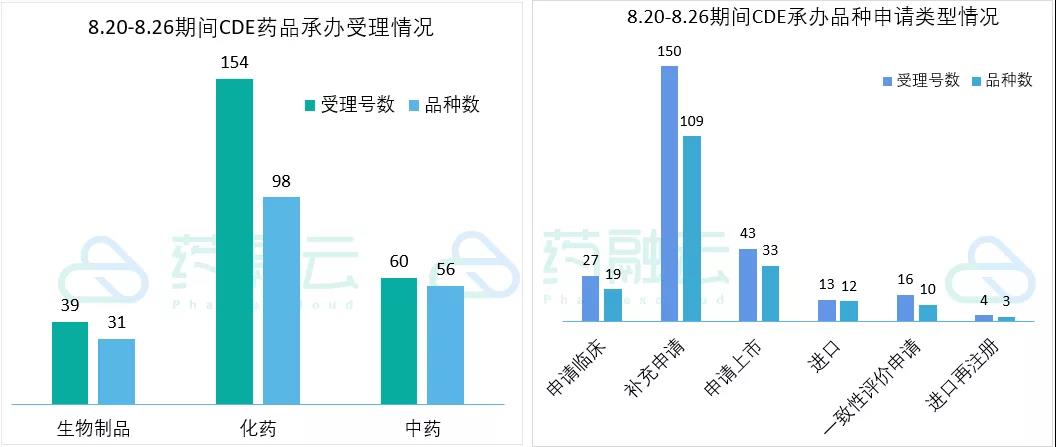
根据药融云中国药品审评数据,8月20号-8月26号期间共185个(按品种计,下同)药品获CDE承办,包括化药98个,生物制品31个,中药56个。
近期CDE承办的共有18个品种申报临床,其中包括16款国产新药,另有10个品种提交一致性评价。
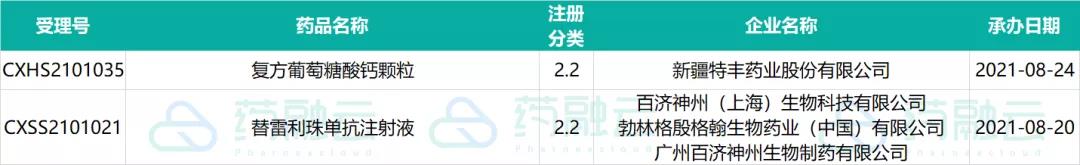
近期受理国产新药共计24个受理号,有18个品种,其中新疆特丰药业「复方葡萄糖酸钙颗粒」和百济神州「替雷利珠单抗注射液」为申请上市,其余均为申请临床,这其中包括9款1类新药。
申请上市的新药情况
替雷利珠单抗
百济神州的替雷利珠单抗(商品名:百泽安)是一款人源化lgG4抗程序性死亡受体 1(PD-1)单抗体,设计目的是为尽量减少与巨噬细胞中的 Fcγ 受体结合。
截止目前,百泽安已经在中国获批了5项适应症。此外,有3项新适应症的上市申请正在审评审批阶段,1项新适应症的上市申请已获CDE受理。据推测,此次提交上市申请的新适应症是一线治疗复发或转移性鼻咽癌。
申请临床的新药情况
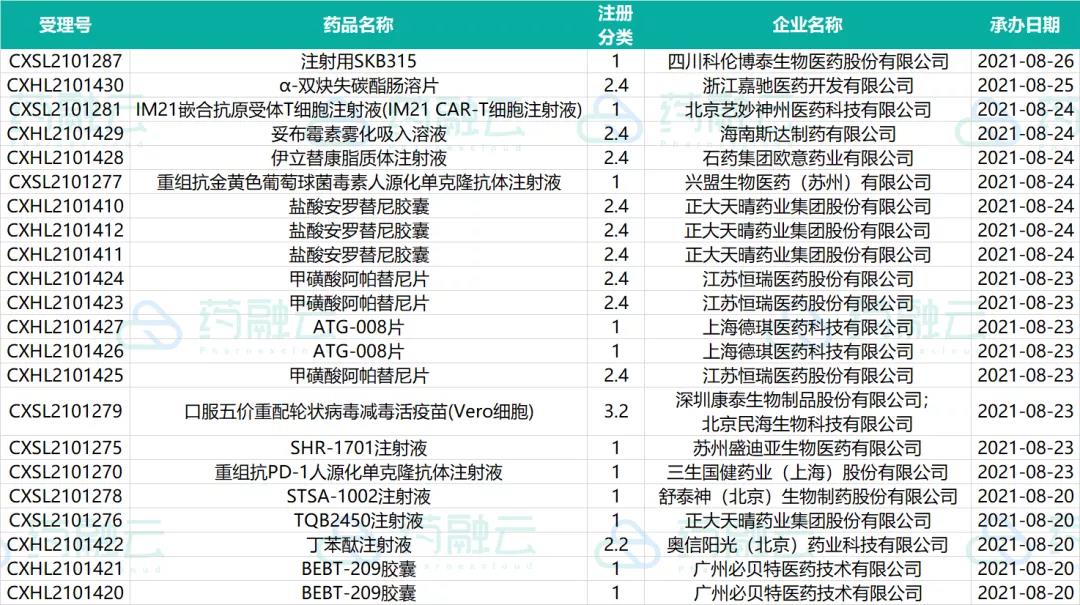
SHR-1701注射液是恒瑞自主研发的抗 PD-L1/TGF-βRII 双功能融合蛋白,可以促进效应性T细胞的活化,同时还可有效改善肿瘤微环境中免疫调节作用,最终促进免疫对肿瘤细胞的杀伤,目前同靶点还有默克和普米斯生物在研。此次,新适应症临床获批,是联合化疗用于复发或转移性鼻咽癌患者的治疗。
STSA-1002注射液是舒泰神北京公司自主研发。STSA-1002系一款靶向C5a的全人源单克隆抗体,能够与过敏毒素C5a特异性结合,从而阻断C5a诱导的中性粒细胞趋化与氧呼吸爆发,同时保留补体系统的溶菌功能。STSA-1002已获FDA批准针对重症新冠的临床试验申请,此次为国内首报IND。
三、在审批阶段
近期共有36个品种(25个受理号)进入审批阶段。
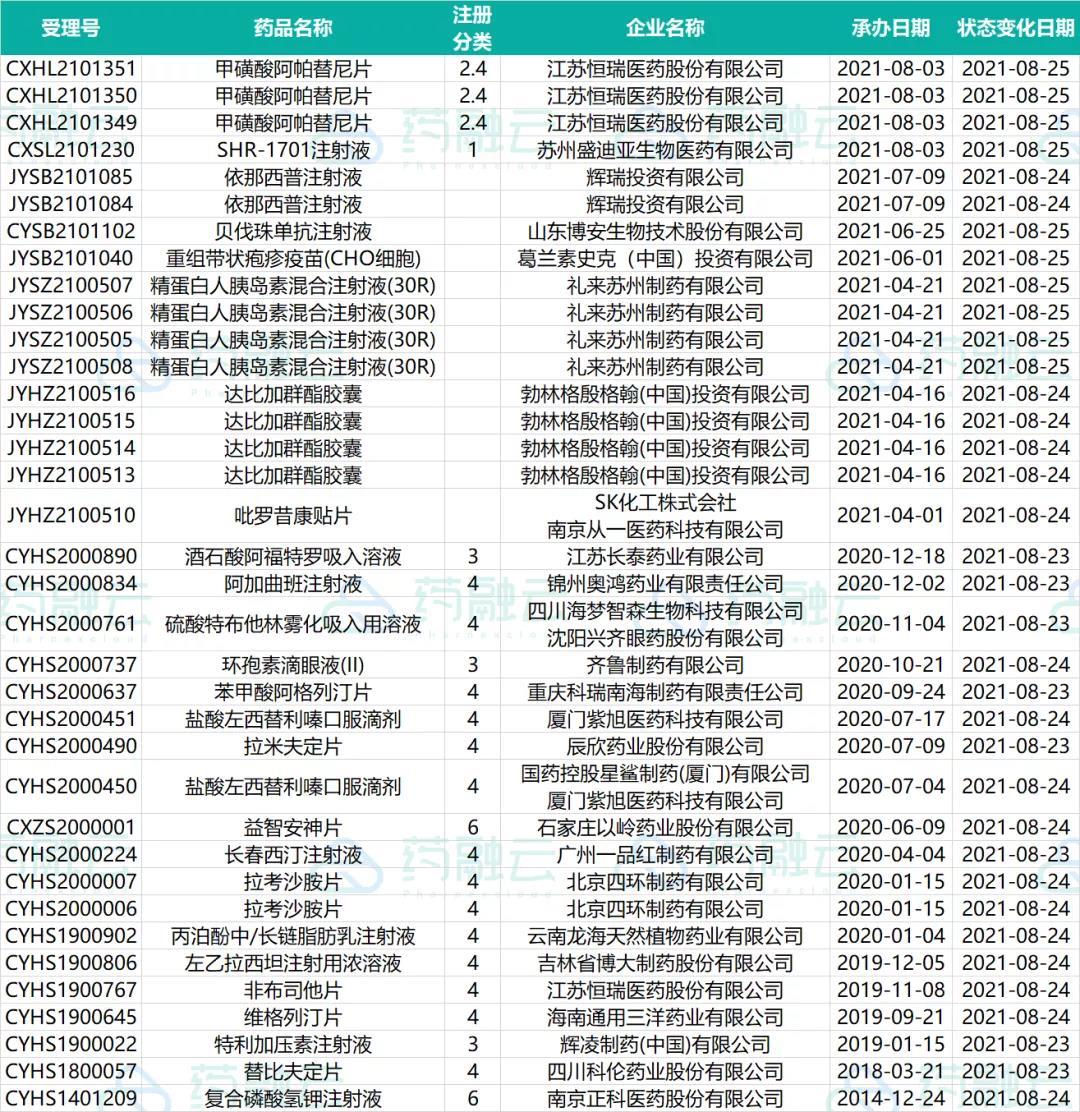
四、一致性评价申请
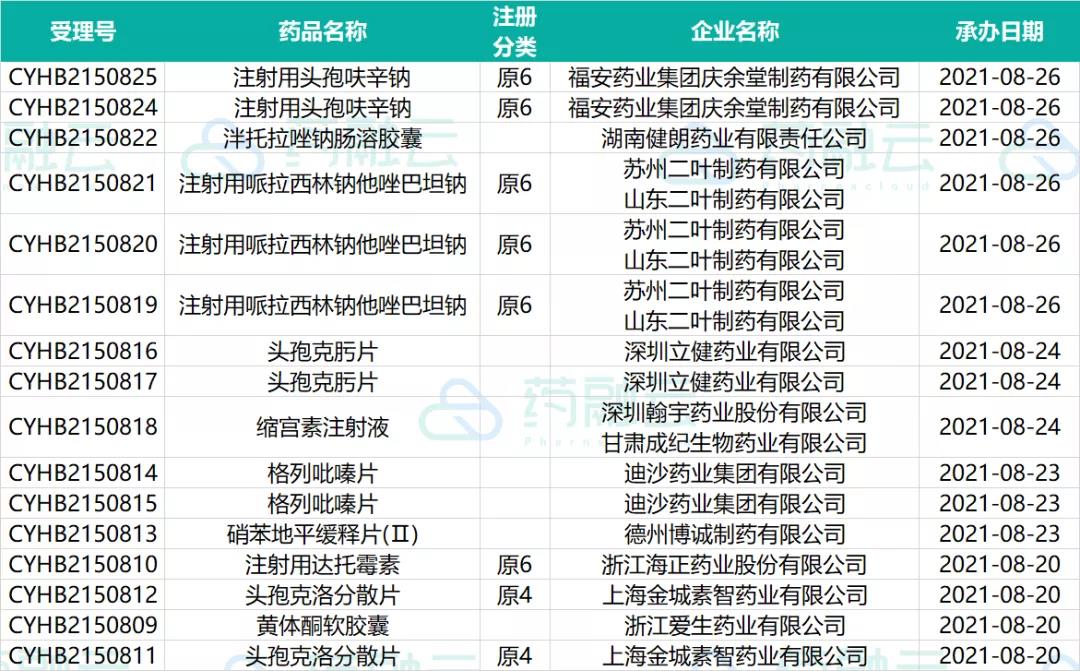
近期有10个品种提交一致性评价申请。

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论