01.首个氘代肿瘤小分子新药,新适应症CDE审评报告出炉
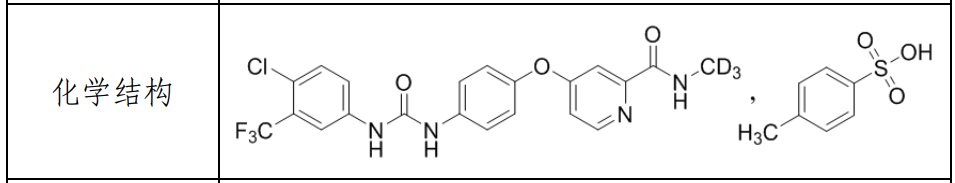
多纳非尼(Donafenib),是利用氢的同位素“氘”的理化优势,将索拉非尼(Sorafenib)分子上的关键代谢靶点吡啶酰甲胺氘代为吡啶酰三氘代甲胺而形成的全新专利药。临床前数据显示:该药既可抑制VEGFR、PDGFR等多种受体酪氨酸激酶的活性,也可直接抑制各种Raf激酶,并抑制下游的Raf/MEK/ERK信号传导通路,抑制肿瘤细胞增殖和肿瘤血管的形成,从而发挥多重抑制、多靶点阻断的抗肿瘤作用。相关专利:WO-2011113203。
药物研发信息(部分,完整内容欢迎登陆“药融云数据库www.pharnexcloud.com/?mh”查看)
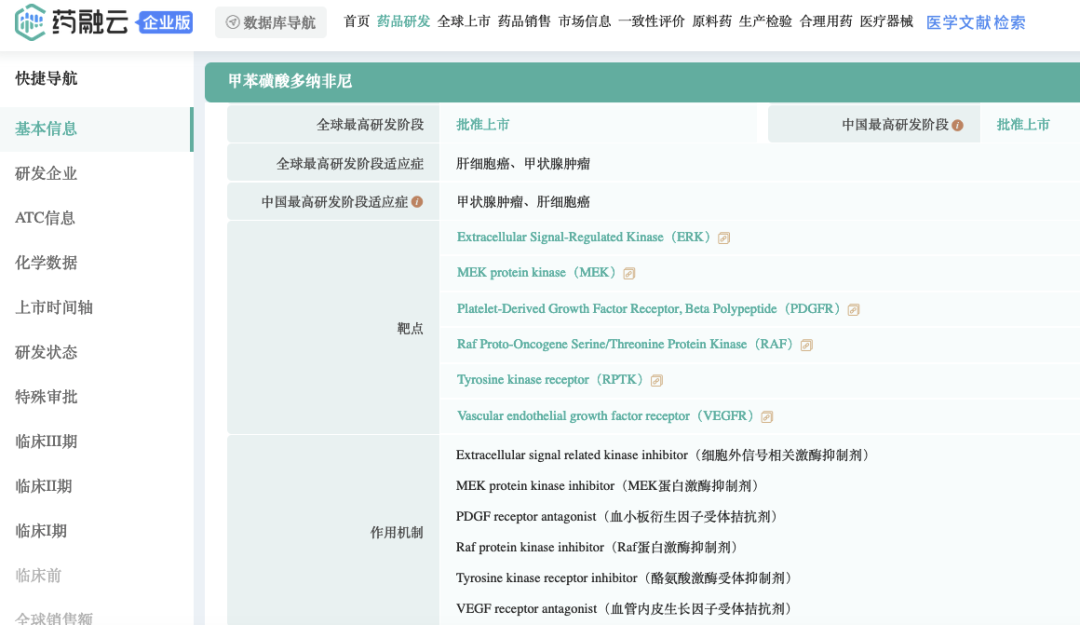
截图来源:药融云全球药物研发数据库
药融圈旗下药融云数据库显示:甲苯磺酸多纳非尼片(商品名:泽普生)是泽璟制药(Suzhou Zelgen Biopharmaceuticals )首个申请新药上市的品种,作为治疗晚期(无法手术或转移性)肝细胞癌的一线用药,于2021年6月在中国获批上市。本品在2022年1月1日起纳入医保目录。2022年8月,本品用于治疗进展性、局部晚期或转移性放射性碘难治性分化型甲状腺癌获准上市。

分享:
我国药审中心CDE近期公布了多纳非尼上市技术审评报告(新适应症)。发送多纳非尼(请正确复制)至药融圈微信公众号(扫描下二维码)后台可获得原文件。仅供学习交流分享!

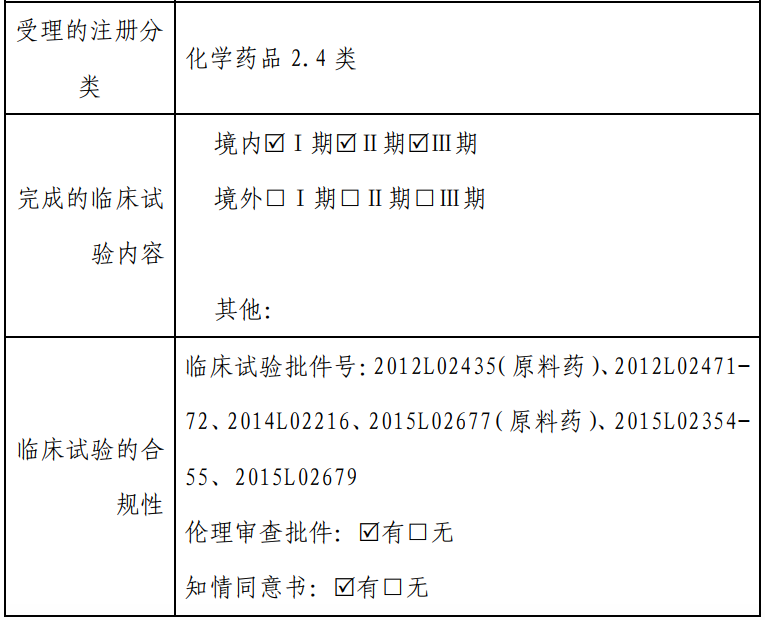
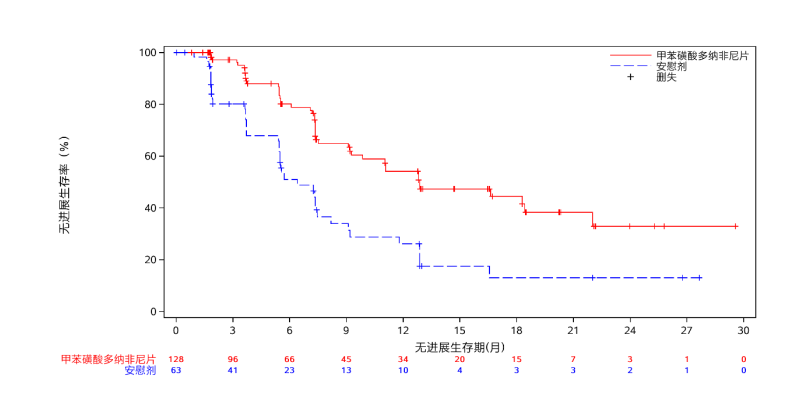

具体而言,关于放射性碘难治性分化型甲状腺癌适应症:
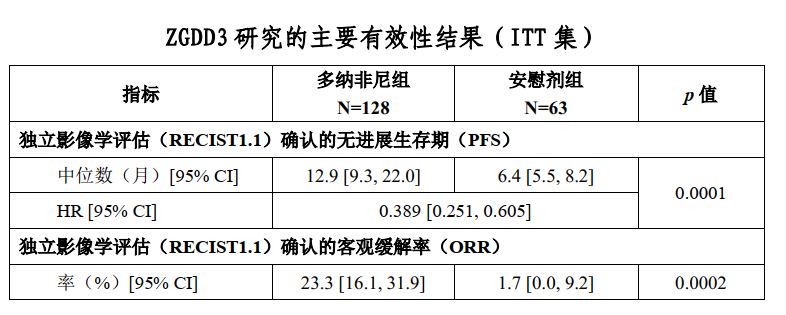
2018年8月至2021年2月,共入组191例患者(多纳非尼组128例,安慰剂组63例),是至今入组最多中国RAIR-DTC患者的研究。
预设亚组分析结果显示:无TKI治疗史的患者,mPFS分别是18.3和7.4个月(HR 0.445,95% CI 0.272-0.729);有TKI治疗史的患者,分别是11.0和3.7个月(HR 0.227,95% CI 0.085-0.609)。差异均具有显著性。
主要研究终点,多纳非尼组和安慰剂组的mPFS分别是12.9和6.4个月(HR 0.389,95% CI 0.251-0.605,p<0.0001),差异有显著性。次要研究终点中,两组的ORR(23.3% vs 1.7%,p=0.0002)有显著差异。中位OS未达到,在治疗后18个月的生存率,分别为88.3%和73.5%。
安全性方面,多纳非尼组有56例(43.8%)发生≥3级的治疗相关不良事件(TRAE),无治疗相关死亡发生。多纳非尼组最常发生的TRAE为高血压(13.3%)和掌跖红肿综合征(12.5%)。另外,多纳非尼的平均日剂量为522 mg/天,为起始剂量(600 mg/天)的87%。
02.泽璟制药不断投入研发,最新产品管线布局
泽璟制药2022年财年营收3.05亿元,同比增长60.18%。其中药品销售收入3.04亿元。由于不断的研发投入等等,目前公司净亏损4.99亿元。公司研发投入(R&D)约5亿人民币。

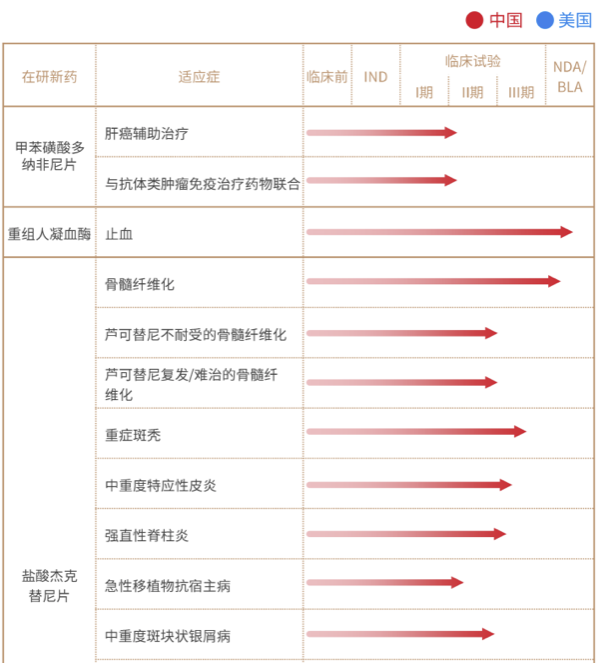
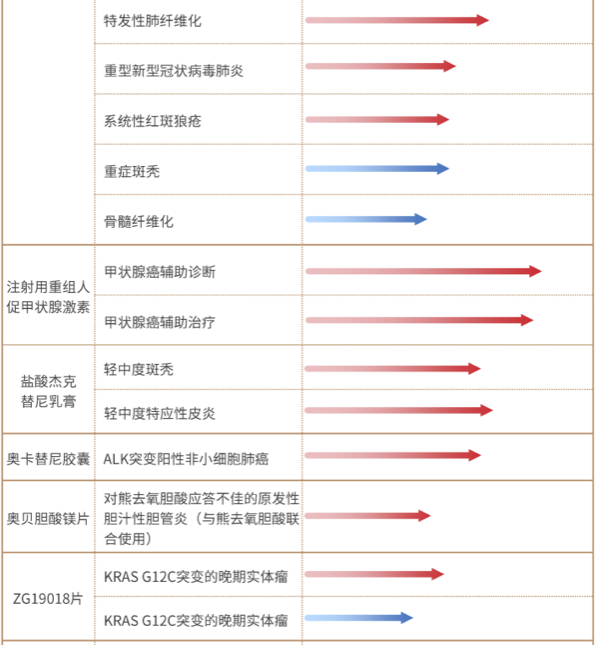
泽璟制药,专注于肿瘤、出血及血液疾病、免疫炎症性疾病和肝胆疾病等多个治疗领域的创新驱动型化学及生物新药研发和生产企业,致力于研发和生产具有全球自主知识产权、安全、有效、患者可负担的创新药物,以满足国内外巨大的临床需求。最新产品线如下:

图 | 2022报告资料
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据库vip.pharnexcloud.com/?mh;
FDA/EMA/PMDA;
泽璟制药公司公开披露;
nmpa.gov.cn;
https://www.cde.org.cn/main/xxgk/postmarketpage?acceptidCODE=7e67f0ed962c7ae231a64ac7120afaf5;
https://mp.weixin.qq.com/s/j5jQmK2xomNLcgIgM8u2PA;等等。
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论