日本武田制药是亚洲销售业绩最大的跨国生物制药公司,2019年1月8日,武田制药豪掷460亿英镑收购英国罕见病制药巨头Shire(生锐),可谓医药界的“蛇吞象”并购,前者随即跻身全球十大生物制药公司。这一经典收购案在当时尤为被外界瞩目。如今,已经过去了两年多的时间,2021年5月,武田公布2020财年业绩,虽然经历了疫情的冲击,但武田的业绩表现依旧强劲,并且有望在2021财年加速增长。
一、关于武田制药
武田制药(Takeda)创立于1781年,总部位于日本东京,是一家以价值观为基础、以研发为驱动的全球生物制药公司,致力于将科学研发成果转化为高度创新药品,为患者的健康生活和美好未来保驾护航。武田专注于四大治疗领域的药物研发:肿瘤、消化、神经科学及罕见病领域,并针对血液制品及疫苗领域进行专项研发投入。

武田制药始终专注于高度创新药物的研发,通过开拓全新治疗方案、增强合作研发引擎实力,打造一条稳健且形式多样的产品管线,助力改善人们的生活。公司员工遍布于大约80个国家和地区,与当地医疗健康合作伙伴携手,为全球患者带来健康福音。
二、2020年主要财务状况
2021年5月11日,武田制药公布了2020财年业绩,2020年4月至2021年3月,公司的全年报告收入为31978亿日元(约合289亿美元),同比下降2.8%,主要是因为受到了外汇和资产剥离的影响,但是武田14个全球品牌产品的业绩同比增长 16 %,其中,ENTYVIO ®(维得利珠单抗)的收入达到4293亿日元(约38.8亿美元),同比增长26.2%;TAKHZYRO ®(拉那利尤单抗)的收入为867亿日元(约7.8亿美元),同比增长30.0%,免疫球蛋白产品收入为3349亿日元(约30.3亿美元)同比增长15.7%。(注:按照当时汇率换算JPY/USD=1/110.6,下同)。
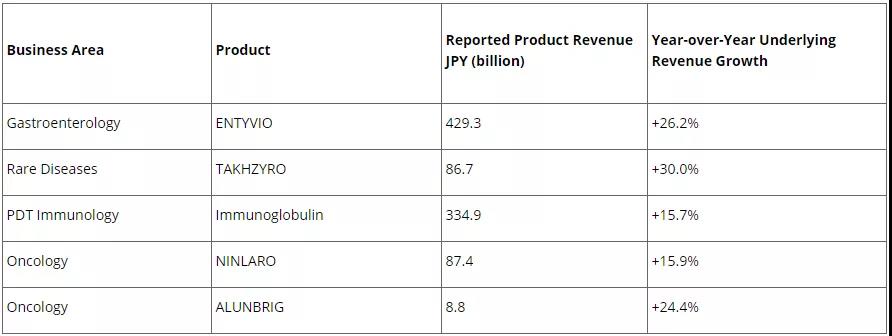
2020财年武田制药全球核心产品业绩
2020财年,武田制药的营业利润为5093亿日元(约合46亿美元),同比增长407.2%,主要业务利润来自非核心资产出售和收购相关的费用。归母净利润为3760亿日元(约34亿美元),同比增长749.9%。核心运营利润同比增长至9679亿日元(约合88亿美元),核心营业利润率为30.3%。进一步调整了外汇和资产剥离的影响,基础核心营业利润率为30.2%,年同比增长13%。主要财务数据如下:

图源:Takeda
经营现金流增加了50.9%,至10109亿日元(约合91.4亿美元),其他金融负债增加了1755亿日元(约合15.9亿美元),主要是由于某些特定疫苗业务的堆积。自由现金流为12378亿日元(约合112亿美元),与上年相比,增加了27.9%,轻松涵盖全年股息、债务偿还和利息。同时,强劲的现金流使得第四季度经营进一步去杠杆化,这反映出武田制药具有韧性的产品组合。
三、五大关键治疗领域最新业务情况

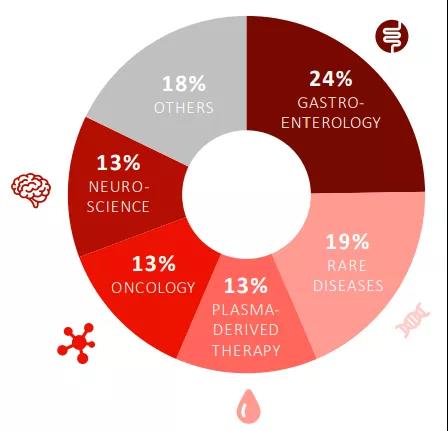
武田有五大关键治疗领域,包括胃肠病学、罕见病、血液制品、肿瘤和神经科学,五个关键领域的列报收入为26237亿日元(约合237亿美元),约占2020财年总收入的82%,基础营收同比增长4.7%。按照治疗领域分,具体产品业绩如下:
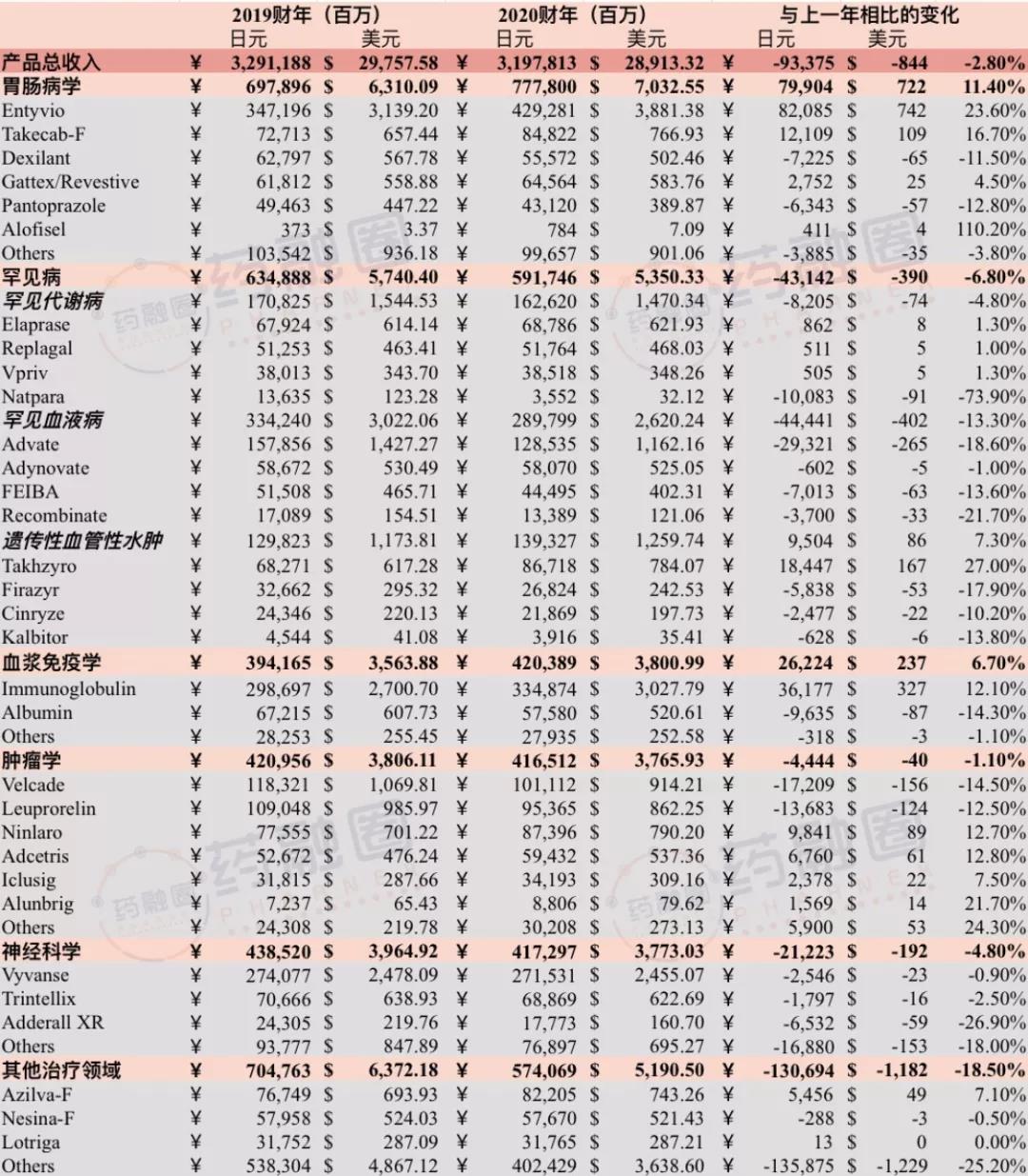
药融圈制图 :武田制药各大产品2020财年业绩
(注:按照当时汇率换算JPY/USD=1/110.6)
#01
胃肠病学
胃肠病学的列报收入为7778亿日元(约合70.33亿美元),同比增长11.4%,占销售额的24%,基础营收增长了14%,这主要得益于胃肠道疾病专用药ENTYVIO(维得利珠单抗)在美国、欧盟和日本一线药物市场份额的持续大幅增长。该药是一种人源化肠道选择性生物制剂,2020年3月11日,ENTYVIO(维得利珠单抗)获得国家药品监督管理局(NMPA)批准正式进入中国,用于治疗中重度活动性溃疡性结肠炎和克罗恩病的成年患者。该药是目前炎症性肠病(IBD)领域唯一的肠道选择性生物制剂,其临床数据表明能够快速起效,并实现长期持久的临床缓解和黏膜愈合,同时安全性好,是欧美国际指南推荐的一线生物制剂。(武田:炎性肠病重磅Vedolizumab上半年大卖20亿美元;国内开售)
#02
罕见病
罕见病的列报收入为5917亿日元(约合53.5亿美元),同比降低6.8%,占销售额的19%,基础营收下降2%,原因是罕见血液病产品业务收入下降,但符合公司预期。遗传性血管性水肿(HAE)产品组合的基础营收增长10%,得益于TAKHZYRO(拉那利尤单抗)持续的强劲表现,该药是一种人单克隆抗体(IgG1类κB),靶向血浆激肽释放酶(pKal),可通过抑制血浆激肽释放酶而阻止缓激肽的生成,用于预防肿胀发生。该药原来由英国罕见病疗法领先公司Shire研发,2019年1月8日,武田制药以460亿英镑完成对Shire的收购,获其罕见病和血浆制品管线。目前,武田正在积极扩张遗传性血管性水肿预防市场,并计划进军其他地区。
#03
血浆免疫学疗法
血浆免疫疗法(PDT Immunology)列报收入为4204亿日元(约合38亿美元),同比增长6.7%,占销售额的13%,基础营收增长10%,主要受美国对Gammagard-Liquid(人免疫球蛋白)及全球对皮下注射免疫球蛋白的强劲需求所推动。Albumin业务2020财年基础营收下降13%,主要由于拟在中国推出的Albumin Glass暂停申报对下半年销售额产生影响。此外,新冠疫情对全行业的血浆采集产生了影响,但武田卓越的运营、数字化的实施计划和血浆采集中心的持续扩张,使血浆采集总量仅下降了11%。
#04
肿瘤学
肿瘤领域列报收入为4165亿日元(约合37.66亿美元),同比下降1.1%,占销售额的13%,基础营收增长1%,主要受多发性骨髓瘤药物NINLARO®(伊沙佐米)、抗体偶联药物ADCETRIS®(brentuximab vedotin)和肺癌药物ALUNBRIG®(brigatinib)所推动。武田还在持续扩张其肿瘤学产品组合的适应症,而且产品组合中增长型品牌抵消了老产品的下滑。
#05
神经科学
神经科学的列报收入为4173亿日元(约合37.73亿美元),同比降低4.8%,占销售额的13%,基础营收下滑2%。该产品组合的增长态势因新冠疫情居家限制,导致患者就诊和诊断减少,因而有所放缓。目前,公司注意到处方数量正在恢复,但新患者用药还未回升到疫情前水平。
图源:Takeda
武田制药总裁兼首席执行官Christophe Weber先生表示:“2020财年,武田在新冠大流行期间以新的方式运作,保持住了韧性。我们的14个全球品牌推动了收入增长,成本协同效应的加速促进了强劲的利润率和现金流。此外,我们持续推进研发管线,并已在我们的关键市场获得了12项批准。2021财年预计将成为一个关键的拐点年,我们将增加研发投入,并进一步推动我们的管线转型,我们有信心在2030财年实现我们的目标,即在未来十年达到5万亿日元(约合470亿美元)的中间个位数收入增长。”

Christophe Weber 图源:Takeda
四、最新研发管线
根据药融云数据(www.pharnexcloud.com)以及武田制药官网公布的最新研发管线,公司仍然专注于肿瘤、罕见病与血液疾病、神经科学、肠胃病,以及疫苗和血液制品领域,2020财年,武田制药的研发费用为4558亿日元(约合41.21亿美元),2021年将是公司的关键拐点年,预计将继续增加研发投入。
武田制药在其研发管线中,制定了wave1和wave2计划,即五年计划和十年计划。wave1的目标是实现短期增长,扩张全球品牌。创新生物制药是武田研发投入的最大组成部分,到2024年,其研发管线中的11个best-in-class / first-in-class新分子实体(NME)有望获得15项批准。
wave2的目标是寻求长期的增长,未来将会有大约30个新分子实体,以及具有治疗潜力和变革性的下一代平台涌现,以支持2025财年之后的可持续增长。两部分管线具体分布如下:

图源:Takeda
#01
肿瘤
Mobocertinib(TAK-788)是武田研发的一种选择性靶向作用于EGFR和人表皮生长因子受体2(HER2)20号外显子插入突变的小分子酪氨酸激酶抑制剂(TKI),用于治疗携带相应插入突变的非小细胞肺癌(NSCLC)患者,2019年12月,Mobocertinib已获得美国食品与药品监督管理局(FDA)孤儿药资格认定,并于2020年4月获得FDA突破性疗法认定。目前,已提交新药申请(NDA),有望于2021财年获得批准。
2020年,美国食品和药物管理局(FDA)已授予武田在研药物Pevonedistat突破性药物资格(BTD),用于治疗高风险骨髓增生异常综合症(HR-MDS)患者,该药是一种首创(first-in-class)的NEDD8激活酶(NAE)抑制剂,有潜力成为十多年来第一个针对HR-MDS患者的创新疗法。
2021年3月9日,武田宣布收购Maverick Therapeutics,以丰富其T细胞实体肿瘤治疗和肿瘤免疫治疗管线。根据协议,武田获得了Maverick的T细胞结合COBRA™平台和其广泛的研发管线,包括领先的候选研发产品TAK-186(MVC-101)和TAK-280(MVC-280)。TAK-186是一种条件性激活T细胞衔接器双抗,目前正在进行1/2期研究,用于治疗表达EGFR的实体瘤,TAK-280(MVC-280)正在研究用于治疗表达B7H3的实体瘤患者,预计将在武田2021财年的下半年进入临床试验。
#02
罕见病
Maribavir(TAK-620)是一款UL97蛋白激酶抑制剂,它具有抑制CMV病毒复制的创新机制。2021年5月21日,武田宣布美国FDA已受理Maribavir(TAK-620)的新药申请(NDA),如果获批,该药将成为首个治疗接受器官移植或造血细胞移植后,发生难治性、有或无耐药性(R/R)巨细胞病毒(CMV)感染患者的药物。美国 FDA曾授予Maribavir突破性疗法认定,用于治疗对既往疗法耐药或难治的移植患者的CMV感染和疾病。本次新药申请是基于Maribavir的关键性3期临床试验结果,试验达到了主要终点,即在R/R CMV感染的移植患者中,它与常规抗病毒治疗相比表现出优效性。
#03
神经科学
Orexin(TAK-994)是一款口服给药的选择性食欲素orexin-2受体(OX2R)激动剂,orexin是下丘脑神经元细胞产生的神经肽,在协调睡眠-觉醒周期方面有重要作用,发作性睡病就是一种由产生食欲素的大脑神经元缺失引起的长期神经系统疾病。研究显示,OX2R激动剂可能替代内源性食欲肽,激活促进清醒的信号通路。目前,武田正在就TAK-994开展一项2期临床试验。
Dravet综合征(Dravet syndrome, DS),原称婴儿严重肌阵挛性癫痫,是一种在婴儿期出现症状的发育性及癫痫性脑病,是一种发病率极低的罕见病。2021年3月4日,武田制药与罕见神经疾病生物制药公司Ovid Therapeutics签订了一项独家协议,根据协议,武田获得Ovid用于治疗发育性和癫痫性脑病的研究药物Soticlestat(TAK-935/OV935)的全球权利,该候选药研发目标包括Dravet综合征和Lennox-Gastaut综合征,武田计划在2021年开启该药的3期临床试验。
#04
胃肠病学
Eohilia(布地奈德口服混悬液),即TAK-721,是一种新型粘附性局部活性口服粘性制剂,用于治疗嗜酸性食管炎(EoE),美国食品和药物管理局(FDA)已受理TAK-721的新药申请(NDA)并授予了优先审查。如果获得批准,TAK-721将成为FDA批准的第一款治疗这种慢性炎症性疾病的药物。此前,FDA已授予TAK-721突破性药物资格和孤儿药资格。
#05
血浆免疫学疗法
血浆免疫学疗法被证明有着良好的抗病毒疗效,先前武田开展过一种潜在的抗病毒多克隆高免疫球蛋白CoVIg-19的研发工作,以测试其治疗新冠肺炎的疗效。但2021年4月,该疗法的3期临床试验未达到其终点,目前,该研究工作已结束。
#06
疫苗
值得一提的是,武田的wave1计划中包含了两款新冠疫苗,分别是与Novavax合作研发的TAK-019,以及与Moderna共同开发的TAK-919,并计划于2021年在日本上市。此外,还有武田四价登革热候选疫苗TAK-003,已完成首次监管申报,有望于2021财年在欧盟和一些登革热流行国家获得批准。
#07
全球品牌产品
此外,武田还在努力扩大14个全球品牌产品的影响力,积极拓展适应症,并推进药物在不同地区上市,以充分发挥其产品价值。
其中,武田的旗舰产品,胃肠道药物ENTYVIO®(维得利珠单抗)已在日本和美国提交申请,该药物还有两个项目处于3期临床试验,其用于预防移植物抗宿主病已获孤儿药认定;
肺癌药物ALUNBRIG®(brigatinib)已在日本和中国获批,用于治疗间变性淋巴瘤激酶阳性(ALK+)非小细胞肺癌(NSCLC),同时也被FDA授予治疗ALK+NSCLC、ROS1+和EGFR+NSCLC的孤儿药资格;
遗传性血管性水肿药物TAKHZYRO®(拉那利尤单抗)已在日本提交上市申请,该药物还有两个项目处于3期临床试验;
NINLARO®(伊沙佐米)因治疗多发性骨髓瘤获得美国FDA和欧盟EMA的孤儿药资格,目前该药已在日本提交上市申请,同时也有两个项目正处于3期临床试验;
ADYNOVATE®是一种聚乙二醇化的(重组)抗血友病因子,用于成年人和年龄12岁以上青少年A型血友病患者的治疗,目前,该药用于治疗小儿A型血友病的研究已进入3期临床试验。具体进度可查看下图:

图源:Takeda
五、武田制药在中国
1994年,武田正式进入中国市场,成立天津武田药品有限公司。而后的十几年,武田在中国不断拓展其业务,加大布局力度,先后成立武田(中国)投资有限公司、武田亚洲开发中心、武田中国物流中心等,如今已成为中国罕见病领域的领航者。目前,武田制药在华产品包括消化疾病、肿瘤、心血管与代谢疾病领域,如潘妥洛克、达克普隆、普托平、恩莱瑞、抑那通、必洛斯、亚宁定、艾可拓、倍欣等。
2020年,武田加码中国,加速转型,制定了五年发展计划,计划未来五年在中国上市约15款创新药物。此外,2020年武田有5款创新产品获得中国国家药监局批准,其中包括针对中重度溃疡性结肠炎和克罗恩病成人患者的突破性生物疗法——注射用维得利珠单抗,鉴于治疗需求巨大,维得利珠单抗被纳入到药物审评中心发布的第一批临床急需境外新药名单,并在提交新药上市申请(NDA)后一年内即通过国家药监局的加速批准。
2021年是中国“十四五”规划的开局之年,也是武田制药成立240周年。这一年也被视为武田的一个重要转折点,公司为此制定了多个里程碑式项目,以确保为中国患者带来更多创新疗法。同时,武田中国的发展计划与“健康中国”建设十分契合,公司希望抓住这个重要的机会,与各方一道满足中国罕见病患者的医疗需求,为这些患者提供同等机会的资金援助和创新治疗。
六、2021财年业绩指引
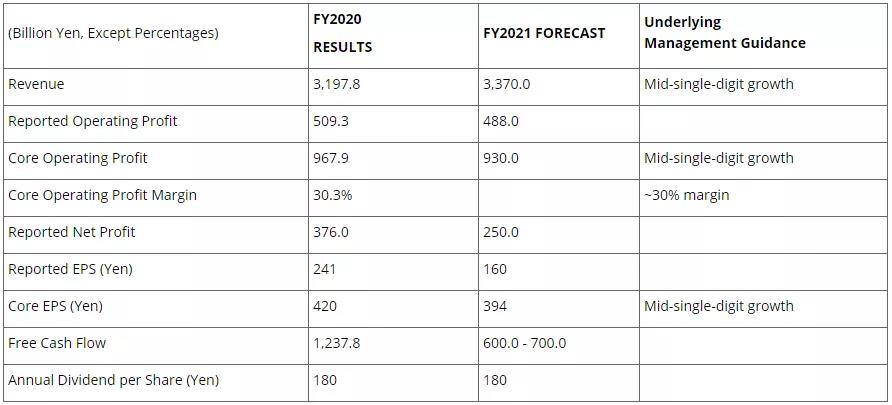
武田制药还公布了2021财年业绩指引,公告指出,武田在 2021 财年拥有强劲的增长势头,预计在武田14个全球品牌的持续推动下,潜在收入增长将加速至“个位数”。报告收入预计为3.37万亿日元,同比增长1722亿日元或较2020财年增长5.4%,基本收入势头和在日本出售糖尿病组合的一次性收益完全抵消了2020 财年资产剥离的影响。(肥东县海森医药3.22亿美元收购武田中国大陆非核心业务)
图源:Takeda
基本核心运营利润和基本核心每股收益预计也将以“个位数”增长,反映了收入增长和持续的成本协同效益,同时研发费用大幅增加,以支持武田的创新研发管道。
七、最新动态
- 5月24日,武田制药公布了其登革热疫苗TAK-003在全球3期临床研究(TIDES)中的3年随访结果。数据显示,尽管疫苗功效随着时间递减,但是TAK-003预防登革热感染的有效率仍然能达到62.0%。
- 5月24日,CDE官网公示,武田口服小分子新药Mobocertinib胶囊上市申请拟纳入优先审评并开始公示。申报上市适应症为:治疗既往接受过化疗且携带表皮生长因子受体(EGFR)20号外显子(Exon20)插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
- 5月21日,武田制药宣布,美国FDA已受理Maribavir(TAK-620)的新药申请(NDA),用于接受器官移植或造血细胞移植后,发生难治性、有或无耐药性(R/R)巨细胞病毒(CMV)感染。
- 5月21日,武田制药宣布,厚生劳动省(MHLW)根据《药品和医疗器械法》第14-3条规定,特别批准在日本紧急使用Moderna的mRNA COVID-19疫苗TAK-919。
-5月11日,武田制药表示,其或将Moderna新冠疫苗进口量提高一倍,以推进该国疫苗接种工作。
八、主要发展历程
1781年,武田创立,长兵卫开始在日本大阪销售传统草药。
1871-1970年代,现代化转型,1871年明治时代初期,武田转型开始售卖西药,成为日本西药贸易的先驱。1895年开始西药生产,1914年投入研发,加速本土发展,1962年开始走向海外市场。
1980-1990年代,拓展国际业务,通过一系列重磅产品在全球多个国家和地区的成功上市,加速全球化进程,并于1994年进入中国。
2000年起,加速全球化,完成一系列全球收购,包括美国千禧、奈科明等。
2018年,纽约证券交易所上市,武田成为唯一一家同时在东京证交所和纽约证交所上市的制药公司。
2019年,收购Shire,武田成为全球领先的生物制药企业,业务遍布约80个国家和地区。
2020年,全球药企Top10。武田跻身全球药企前十,亚洲第一,成为全球生物制药的领导者之一。武田加码中国,加速转型,制定了五年发展计划。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论