
引言:一周一见的CDE药品审评周报来了!国内首款ROR1 ADC药物报临床;仿制药承办数量明显下降!详情见下(文中统计结果不包括补充申请&进口再注册)。
创新药承办情况
2022年2月28-3月6日CDE共承办33个创新药受理号,其中包括了化药受理号24个,生物制品受理号9个,无中药受理号。此次的32个1类新药受理号包括29个临床试验申请,4个上市注册申请。
化药创新药
此次申报的化药分别为HEC137076MsOH片、FCN-159片、LNP023胶囊、SAP-001片、Tirzepatide注射液、倍赛诺他片、加格列净片。
加格列净片:此药为此次承办的1类新药中唯一的上市注册申请药品。根据CDE官网显示信息,该药首次申报临床为2014年10月。根据四环制药官网披露信息,加格列净是钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂,官网还提到此药为第二个在国内进行上市申请并获得受理的国产1类创新药SGLT-2抑制剂。
HEC137076MsOH片:该药为首次申报临床,靶点和适应症暂未公布。
FCN-159片:该新药为复星医药自主研发的创新型小分子化学药物,为 MEK1/2 选择性抑制剂,拟主要用于晚期实体瘤、I 型神经纤维瘤的治疗。此药上一次临床试验申请被承办日期为2022年2月25日。
LNP023胶囊:此药为诺华开发的一款口服的特异性“first-in-class”补体因子B抑制剂,可通过靶向补体替代信号通路,阻断血管内和血管间溶血。目前,这款创新疗法在临床试验中用于治疗阵发性睡眠性血红蛋白尿症(PNH)、特发性膜性肾病、IgA肾病、原发性IgA肾病,以及本次获批的C3肾小球病。
SAP-001片:此药为上海珊顿医药科技有限公司旗下的一款治疗痛风的药物。据上海珊顿官网披露信息显示,此药目前处于二期临床阶段。
Tirzepatide注射液:Tirzepatide是礼来公司的一款胃抑制多肽(GIP)/胰高血糖素样肽-1(GLP-1)受体双重激动剂。除对2型糖尿病和肥胖症疗效显著外,对非酒精性脂肪性肝炎也显示出一定的治疗潜力。
倍赛诺他片:该药为上海驺虞医药旗下的一款HDAC抑制剂,此次为首次申报临床。
生物制品创新药
此次申报的生物制品分别为:Tremelimumab、注射用QLS31904、TG103注射液、注射用CS5001、DXC004A、GZR101、基因重组腮腺炎减毒活疫苗(F基因型)、FTL001单抗注射液、重组人源化单克隆抗体MIL98注射液。
Tremelimumab:此药是一种全人源单克隆抗体,可与活化 T 淋巴细胞表面的细胞毒性 T 淋巴细胞相关蛋白 4 (CTLA-4) 结合。tremelimumab最早由辉瑞开发,于2011年将产品转让给MedImmune(2007年被阿斯利康收购)。
注射用QLS31904:该药为首次申报临床,靶点和适应症暂未公布。
TG103注射液:暂未查到该药对应靶点和适应症。
注射用CS5001:此药为一款靶向酪氨酸激酶样孤儿受体1(ROR1)的潜在全球同类最佳抗体偶联药物(ADC),也是国内首款ROR1 ADC药物报临床。此次为该药首次在国内申报临床。
DXC004A:此药为多禧生物第5款申报临床的ADC药物,其余四款分别为:DXC007、靶向Muc-1-C的DAC-005、靶向Trop-2的DAC-002、靶向HER-2的DX126-262。此次为该药首次在国内申报临床。
GZR101:该药为首次申报临床,靶点和适应症暂未公布。
FTL001单抗注射液:根据非同生物官网披露信息显示,FTL001为一款靶向4-1BB的单抗。
创新药承办情况

改良型新药承办情况
2022年2月28-3月6日CDE共承办6个改良型新药受理号,包括2个上市注册申请和4个临床试验申请。
2个上市注册申请分别为:上海药明巨诺生物的瑞基奥仑赛注射液和宜昌人福的异氟烷注射液。其中瑞基奥仑赛注射液(倍诺达)为首款中国自主开发的、获批为1类生物制品的CAR-T产品,全球第六款获批的CAR-T产品。
4个临床试验申请分别为:恒瑞医药的HR19042胶囊、HR19024注射液、HRG2005吸入剂以及百济神州的泽布替尼胶囊。
改良型新药承办情况

一致性评价承办情况
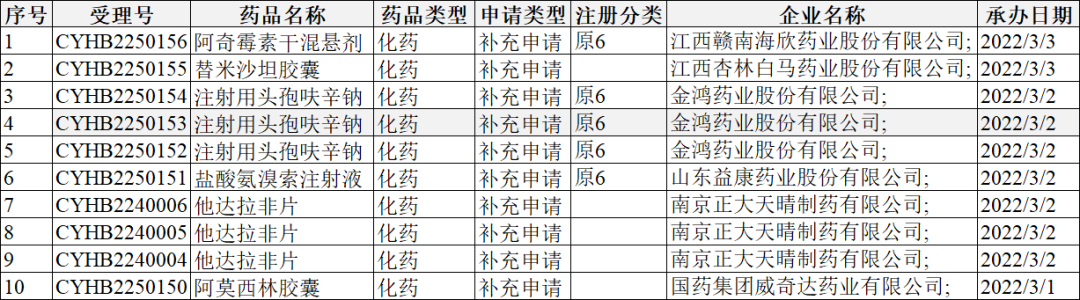
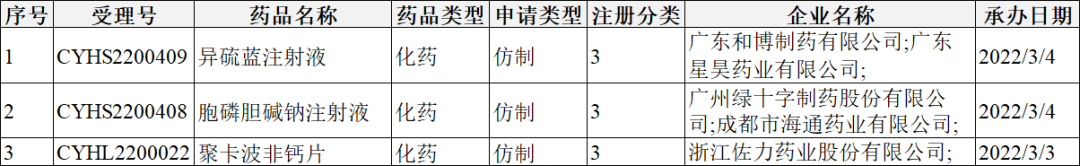
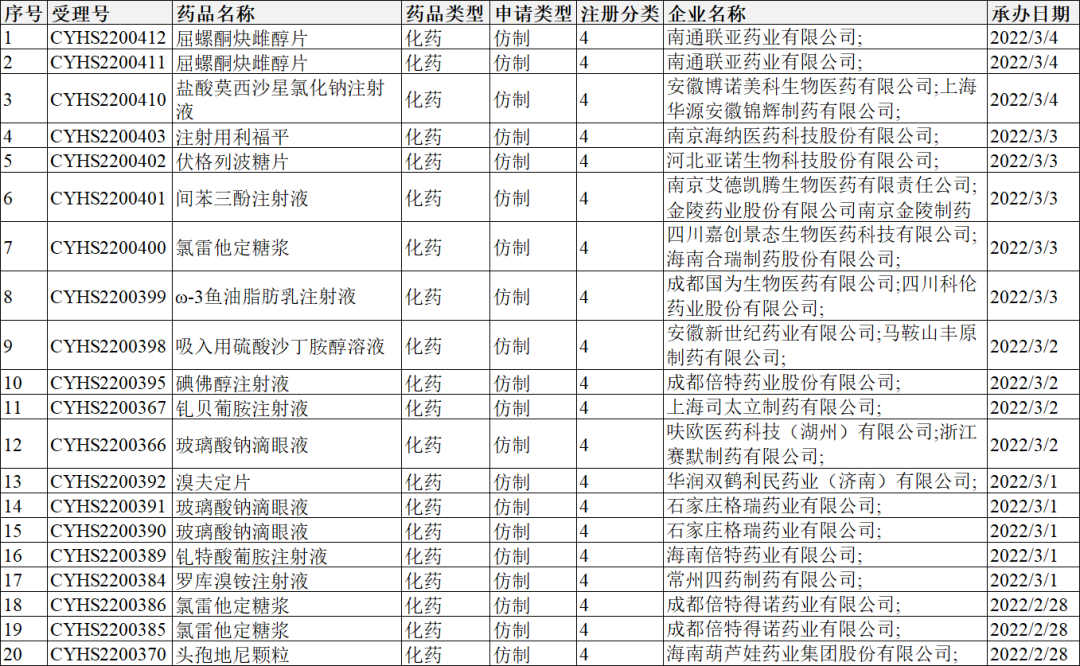
2022年2月28-3月6日CDE共承办10个一致性评价受理号,详情见下表。
注册分类:3类
注册分类:4类
注册分类:5类
本周CDE没有承办注册分类5类药品。
想要解锁更多药品审评信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握各类药品申报情况、最新进展、涉及靶点及适应症、市场规模与前景、可否投入仿制与研发!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论