1.5.1 本周全球TOP10创新药研发进展

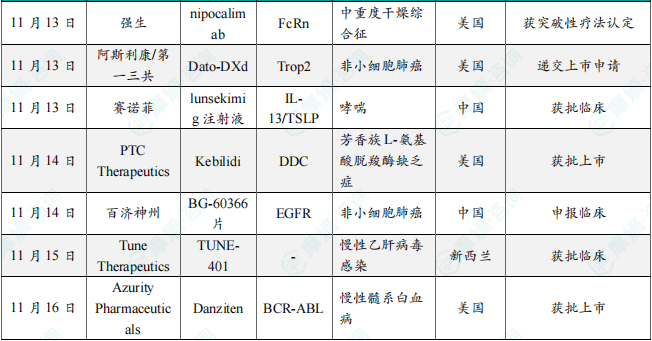
(1)再鼎医药艾加莫德α注射液新适应症在华获批,针对多发性神经根神经病
11月11日,中国国家药监局(NMPA)官网最新公示,再鼎医药艾加莫德注射液(皮下注射)的新适应症上市申请已获批准。根据CDE此前优先审评信息,该药本次获批的适应症为治疗成人慢性炎性脱髓鞘性多发性神经根神经病(CIDP)。此前,美国FDA已批准艾加莫德皮下注射用于治疗CIDP。Argenx公司新闻稿指出,这是30多年来首个获得FDA批准且具有明确作用机制的CIDP新疗法。它也是首个获批用于治疗CIDP的新生Fc受体(FcRn)阻断剂。
(2)金赛药业PD-1激动剂1类新药申报临床,针对自身免疫性疾病
11月11日,中国国家药监局药品审评中心(CDE)官网最新公示,金赛药业申报的GenSci120注射液临床试验申请获得受理。根据金赛药业公开资料,GenSci120注射液是一款PD-1激动剂。程序性细胞死亡蛋白受体1(PD-1)在肿瘤治疗中已经发挥了极其重要的作用,但这一靶点在自身免疫疾病治疗中的潜力还远远未被发掘。动物模型中已有研究显示,PD-1/L1与多种自身免疫性疾病的发生有关,包括系统性红斑狼疮、心肌炎、类风湿关节炎和炎症性肠病等。从作用机制上看,PD-1激动剂可以与PD-1结合,并抑制淋巴细胞的激活和扩增,从而减弱T细胞的功能。因此,科学家们正在探索PD-1激动剂在自身免疫性疾病中的应用。
(3)先衍生物高血压1类新药在中国获批临床,拟开发治疗原发性高血压
11月12日,中国国家药监局药品审评中心(CDE)官网公示,先衍生物申报的1类新药LDR2402注射液获批临床,拟开发治疗原发性高血压。根据先衍生物公开资料,这是一款靶向血管紧张素原(AGT)的小核酸新药。已有的临床前研究表明,该产品在临床治疗中有可能通过延长给药间隔(每季度或半年给药一次)提高患者依从性,并可能通过维持24小时血压减少血压变异性(BPV),给高血压患者带来心血管获益。针对高血压的治疗瓶颈,siRNA药物可直接降低AGT的表达,具有药物作用效果持久、安全性好、患者依从性高等差异化优势,有望为患者带来更好的治疗选择和长期获益。
(4)强生潜在重磅单抗获突破性疗法认定,治疗中重度干燥综合征
11月13日,强生宣布美国FDA已授予其靶向新生儿Fc受体(FcRn)的在研抗体疗法nipocalimab突破性疗法认定(BTD),用于治疗中度至重度干燥综合征(SjD)成人患者。Nipocalimab是一款潜在“best-in-class”,靶向FcRn的抗体疗法。它通过与FcRn结合,让被单核细胞和内皮细胞摄入的自身抗体不会重新释放到血液中,而是在细胞内被降解。已有研究显示,它可以将血液循环中包括致病自身抗体在内的IgG水平降低超过75%。这款抗体疗法有望治疗多种自身抗体介导的免疫疾病。根据新闻稿,nipocalimab是在SjD领域获得BTD的首个疗法。值得一提的是,这款疗法今年年初被行业媒体Evaluate列为10大潜在重磅在研疗法之一。
(5)阿斯利康/第一三共潜在重磅Trop2 ADC向FDA递交上市申请,针对非小细胞肺癌
11月13日,阿斯利康和第一三共宣布,根据美国FDA的反馈,两家公司已为其联合开发的Trop2靶向抗体偶联药物datopotamab deruxtecan(Dato-DXd)递交生物制品许可申请,寻求该疗法获加速批准,用以治疗携带表皮生长因子受体突变肿瘤的局部晚期或转移性非小细胞肺癌成年患者,这些患者之前曾接受过全身性治疗(包括EGFR靶向治疗)。Datopotamab deruxtecan是一种靶向Trop2的ADC,通过第一三共的专有DXd ADC技术设计,由一种人源化抗Trop2单克隆抗体,与多个拓扑异构酶I抑制剂有效载荷(DXd)通过可裂解的四肽连接子偶联生成。
(6)赛诺菲双抗1类新药在中国再获批临床,治疗哮喘
11月13日,中国国家药监局药品审评中心(CDE)官网公示,赛诺菲(Sanofi)申报的1类新药lunsekimig注射液获得一项新的临床试验默示许可,拟开发用于治疗成人高风险哮喘。该产品此前已经在中国获批IND,针对适应症为成人中重度哮喘。公开资料显示,lunsekimig(此前研发代号为SAR443765)是一款将靶向IL-13和靶向TSLP的重链可变区(VHH)连接在一起的纳米抗体。这款药物是一款胸腺基质淋巴细胞生成素(TSLP)和白细胞介素-13(IL-13)双重阻断剂。IL-13和TSLP都是在免疫学和炎症领域已经经过验证的靶点,也是哮喘病理生理的关键介质。同时抑制这两条信号通路可能产生协同作用,产生更强的疗效。
(7)PTC Therapeutics直接注入大脑的基因疗法获FDA批准,针对罕见病
11月14日,PTC Therapeutics宣布,美国FDA加速批准基因疗法Kebilidi(eladocagene exuparvovec)用于治疗芳香族L-氨基酸脱羧酶缺乏症(AADCD)的儿童和成人患者,无论他们的疾病严重程度为何。根据新闻稿,这是FDA批准的首个直接注射到大脑的基因疗法。AADCD是一种致病率极高且会缩短寿命的罕见遗传性疾病,患者由于编码AADC酶的DDC基因出现变异,导致AADC酶功能缺失,因此患者无法合成多巴胺。Kebilidi是一种基于腺相关病毒2(AAV2)载体的基因疗法,旨在通过一次性治疗,将功能正常的DDC基因直接递送到大脑的壳核中,提高AADC酶的水平并恢复多巴胺的生产。2022年,它首次获得欧盟委员会批准上市(商品名Upstaza),成为直接注入大脑的首款获批基因疗法,也是改变AADCD疾病进程的首款获批疗法。
(8)百济神州新型EGFR降解剂1类新药申报临床
11月14日,国家药监局药品审评中心(CDE)官网最新公示,百济神州1类新药BG-60366片临床试验申请获得受理。根据百济神州刚刚公布的第三季度报告可知,这是一款新型EGFR降解剂(EGFR CDAC),其具有差异化作用机制,有望实现EGFR信号完全抑制。本次是该产品首次在中国申报IND,百济神州预计该产品在2024年第四季度可按期进入临床。根据百济神州官网资料介绍,BG-60366是一款新型EGFR嵌合式降解激活化合物(CDAC),该产品可广泛覆盖多种EGFR突变,破坏EGFR支架功能,产生持久的信号抑制作用。当用于前期治疗线时,非冗余机制有望防止发生耐药。
(9)Tune Therapeutics潜在"first-in-class"表观遗传疗法获批临床,治疗慢性乙肝病毒感染
11月15日,Tune Therapeutics宣布,该公司已获得新西兰药品和医疗器械安全局(Medsafe)的临床试验申请(CTA)批准,将推进其用于治疗慢性乙肝病毒(HBV)感染的表观遗传沉默剂TUNE-401进入1b期临床试验。TUNE-401是一款潜在"first-in-class"的表观遗传沉默剂,开发用以治疗HBV感染患者,TUNE-401利用脂质纳米颗粒(LNP)将编码活性、HBV靶向的RNA直接递送至肝细胞,在这些细胞内,所递送的RNA被翻译为表观沉默蛋白,靶向整合入宿主细胞的乙肝病毒DNA(intDNA)和共价闭合环状DNA(cccDNA)。根据新闻稿,TUNE-401是首个进入临床、旨在表观遗传水平上沉默靶向整合入宿主细胞的乙肝病毒DNA和cccDNA的疗法。
(10)Azurity抗癌小分子疗法获美国FDA批准上市,治疗慢性髓系白血病
11月16日,Azurity Pharmaceuticals宣布,美国FDA已批准Danziten(nilotinib)用于治疗新确诊的费城染色体阳性慢性髓系白血病(Ph+ CML)慢性期(CP)成年患者,以及对包括伊马替尼(imatinib)在内的既往疗法有耐药或不耐受的慢性期和急性期(AP)成年患者。根据新闻稿,这是FDA批准的首个无需用餐限制的nilotinib药物。Nilotinib是一款BCR-ABL激酶抑制剂,该药物能与ABL蛋白激酶域的非活性构象结合并稳定其构象。体外实验中,nilotinib可抑制BCR-ABL介导的小鼠白血病细胞系和Ph+ CML患者衍生的人类细胞系的增殖。在测试的33种BCR-ABL激酶突变中,nilotinib对32种伊马替尼耐药性突变仍具有活性。
1.5.2本周全球TOP10积极/失败临床结果
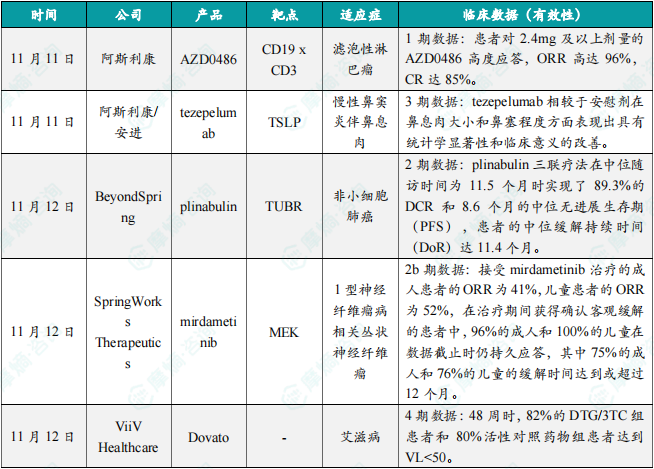
(1)阿斯利康CD19 x CD3靶向双特异性T细胞接合器1期结果积极
11月11日,阿斯利康宣布将在今年的美国血液学会(ASH)年会上公布旗下多款血液学管线的临床结果,其中包括该公司的CD19 x CD3靶向双特异性T细胞接合器AZD0486用于复发/难治性滤泡性淋巴瘤患者的1期临床试验结果。结果显示,R/R FL患者对2.4 mg及以上剂量的AZD0486高度应答,患者的ORR高达96%,CR达85%,且患者的最小残留病灶(MRD)阴性比率很高。此外,1期试验中期结果也显示,接受过大量治疗的弥漫大B细胞淋巴瘤(DLBCL)患者也对AZD0486高度应答,患者的CR率高。
(2)阿斯利康/安进“first-in-class" 单抗3期积极结果公布,针对慢性鼻窦炎
11月11日,阿斯利康(AstraZeneca)与安进(Amgen)合作开发的“first-in-class”单抗Tezspire(tezepelumab)针对伴有鼻息肉的慢性鼻窦炎(CRSwNP)患者进行的WAYPOINT临床3期试验积极结果公布。WAYPOINT是一项随机双盲试验,旨在评估皮下注射Tezspire与安慰剂相比,对重度CRSwNP成人患者的疗效和安全性。试验受试者尽管接受了鼻内皮质类固醇(INCS)标准治疗,但症状仍未缓解。分析显示,Tezspire相较于安慰剂在鼻息肉大小和鼻塞程度方面表现出具有统计学显著性和临床意义的改善。本次试验中Tezspire的安全性和耐受性与该药物的已知特性一致。
(3)BeyondSpring潜在“first-in-class"微管蛋白抑制剂2期结果积极,近90%疾病控制率
11月12日,BeyondSpring公布研究者发起的临床2期试验KeyPelms-004的最新数据,旗下Plinabulin是一种新型、潜在“first-in-class"的树突状细胞成熟剂,也是一款靶向微管蛋白口袋的可逆性结合剂。分析显示,接受其在研小分子药物plinabulin、多西他赛(docetaxel)与PD-1抑制剂pembrolizumab三联疗法治疗的转移性非小细胞肺癌(NSCLC)患者在中位随访时间为11.5个月时实现了89.3%的DCR和8.6个月的中位无进展生存期(PFS),患者的中位缓解持续时间(DoR)达11.4个月。此外,该药物组合通常耐受性良好。46.7%的患者经历了3级或更高级别的治疗相关不良反应。最常见的不良反应是骨髓抑制(13.3%)、胃肠道副作用(13.3%)和短暂性高血压(6.7%)。没有治疗相关死亡病例。
(4)SpringWorks潜在“best-in-class”变构小分子关键试验结果发布,针对神经纤维瘤
11月12日,SpringWorks Therapeutics宣布在《临床肿瘤学杂志》发表其在研MEK抑制剂mirdametinib用于治疗1型神经纤维瘤病相关丛状神经纤维瘤(NF1-PN)成人和儿童患者的关键2b期ReNeu试验的数据。分析显示,在24个治疗周期(约22个月)内,接受mirdametinib治疗的成人患者的ORR为41%(95% CI:29至55;n=24/58),儿童患者的ORR为52%(95% CI:38至65;n=29/56)。在治疗期间获得确认客观缓解的患者中,96%的成人和100%的儿童在数据截止时仍持久应答,其中75%的成人和76%的儿童的缓解时间达到或超过12个月。成人患者达到确认缓解的中位时间为7.8个月(范围:4至19个月),儿童为7.9个月(范围:4.1至18.8个月)。
(5)ViiV Healthcare艾滋病双药疗法积极结果公布,超80%患者达主要终点
11月12日,ViiV Healthcare公布了其双药复方抗病毒疗法Dovato (dolutegravir/lamivudine,DTG/3TC)DOLCE研究的48周结果。分析显示,在试验第48周时观察到两个队列展现相似的疗效,82%的DTG/3TC组患者和80%活性对照药物组患者达到VL<50。此外,事后分析表明,DTG/3TC组在实现VL<50方面不劣于活性对照药物(调整风险差异为2.0%;95% CI:-8.6,12.8%)。研究还显示,两组在病毒载量下降、病毒抑制时间和CD4细胞恢复的次要疗效指标上相似。两组患者之间的疗效结果相似,无论患者基线病毒载量的水平为何。其中在基线病毒载量超过50万拷贝的患者中,DTG/3TC组有74%实现了病毒学成功,而活性对照药物组在此数值上为67%。
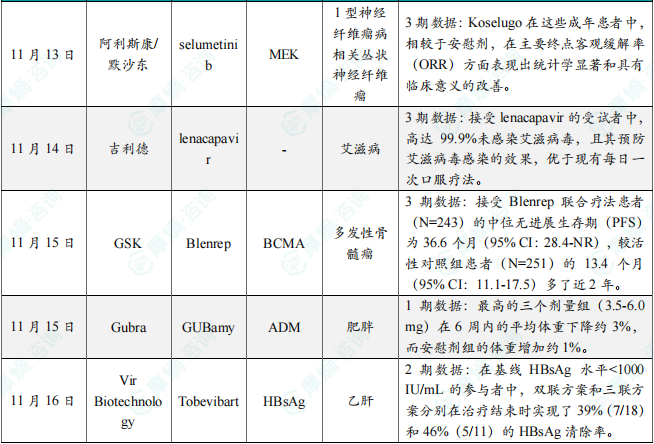
(6)阿斯利康/默沙东突破性小分子3期试验达主要终点,针对神经纤维瘤
11月13日,阿利斯康和默沙东联合公布KOMET临床3期试验的积极顶线结果。分析显示,两家公司共同开发的Koselugo(selumetinib)用于治疗患有症状性、不可手术丛状神经纤维瘤(PN)的1型神经纤维瘤病(NF1)成人患者时,能够使患者的肿瘤体积显著缩小,达成试验主要终点。NF1是一种罕见,不可治愈的遗传性疾病,MEK是RAS/MAPK信号通路中的关键蛋白激酶,Koselugo能够选择性地抑制MEK1和MEK2,从而让失调的信号通路恢复正常,进而缓解NF1患者的病情。结果显示,Koselugo在这些成年患者中,相较于安慰剂,在主要终点客观缓解率(ORR)方面表现出统计学显著和具有临床意义的改善。
(7)吉利德长效HIV疗法lenacapavir 关键3期试验结果公布,99.9%有效
11月14日,吉利德公布其每半年注射一次的艾滋病毒衣壳抑制剂lenacapavir用于预防艾滋病毒(HIV)感染的第二项关键3期试验PURPOSE 2的全部结果。Lenacapavir是一种“first-in-class”长效艾滋病毒衣壳抑制剂,可以干扰艾滋病毒衣壳蛋白的组装和拆卸,在病毒生命周期的多个阶段发挥作用。Lenacapavir在2019年5月获得美国FDA授予的突破性疗法认定,用于联合其他抗逆转录病毒药物治疗多重耐药的重度经治艾滋病毒感染者。分析显示,接受lenacapavir的受试者中,高达99.9%未感染艾滋病毒,且其预防艾滋病毒感染的效果,优于现有每日一次口服疗法。
(8)GSK公布靶向BCMA的ADC疗法的3期临床积极结果,针对多发性骨髓瘤
11月15日,GSK宣布其抗体偶联药物Blenrep在3期临床试验DREAMM-7的预定中期分析中获得了积极结果。该试验评估了Blenrep联合硼替佐米和地塞米松作为复发或难治性多发性骨髓瘤的二线或更晚期治疗的效果。试验达到了总生存期(OS)的关键次要终点,显示出Blenrep联合BorDex与标准治疗方案相比,显著降低了患者死亡风险。此前公布的临床试验数据显示,接受Blenrep联合疗法患者(N=243)的中位无进展生存期(PFS)为36.6个月(95% CI:28.4-NR),较活性对照组患者(N=251)的13.4个月(95% CI:11.1-17.5)多了近2年。
(9)Gubra公司创新减重疗法早期临床结果积极,半衰期为11天,支持每周给药一次
11月15日,Gubra公司宣布了长效胰淀素(amylin)类似物GUBamy在单剂量递增(SAD)1期临床试验中获得积极结果。药代动力学分析显示剂量依赖性,并确认了每周一次的给药方案,半衰期为270小时(11天)。这一试验的数据还表明,单剂量的GUBamy剂量依赖性地降低体重。体重变化在给药后3天即可观察到,并在整个试验期间内持续存在。最高的三个剂量组(3.5-6.0 mg)在6周内的平均体重下降约3%(范围:-1.81%至-3.25%),而安慰剂组的体重增加约1%。Gubra预计将在未来的科学会议上展示单剂量递增研究的结果。GUBamy的多剂量递增(MAD)1期研究正在进行中,预计第一部分的中期结果将在2025年上半年发布。
(10)Vir Biotechnology抗体/siRNA组合疗法最新数据发布,旨在功能性治愈乙肝
11月16日,Vir Biotechnology宣布了2期临床试验MARCH的B部分的最新数据。该研究评估了在研疗法tobevibart和elebsiran联用(加或不加聚乙二醇化干扰素α)在慢性乙型肝炎(CHB)患者中的疗效和安全性。研究显示,在基线HBsAg水平<1000 IU/mL的参与者中,双联方案和三联方案分别在治疗结束时实现了39%(7/18)和46%(5/11)的HBsAg清除率。在包含所有基线HBsAg水平的参与者中,双联方案和三联方案的HBsAg清除率分别为16%(8/51)和22%(6/27)。在双联治疗方案中,实现HBsAg清除的参与者中,有50%(4/8)进一步产生了抗乙肝病毒抗体。在三联治疗方案中,所有实现HBsAg清除的参与者均产生抗乙肝病毒抗体(100%,6/6)。
同期事件:
1. 2024年第46周11.11-11.17国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第46周11.11-11.17国内仿制药/生物类似物申报/审批数据分析
3. 2024年第46周11.11-11.17国内医药大健康行业政策法规汇总
4. 2024年第46周11.11-11.17全球医药大健康行业投融资数据
以上内容均来自{摩熵咨询医药行业观察周报(2024.11.11-2024.11.17)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论