
10月29日,据CDE官网公示,阿斯利康的AZD5492在中国获批临床,拟用于治疗复发性或难治性B细胞恶性肿瘤。

截图来源:CDE
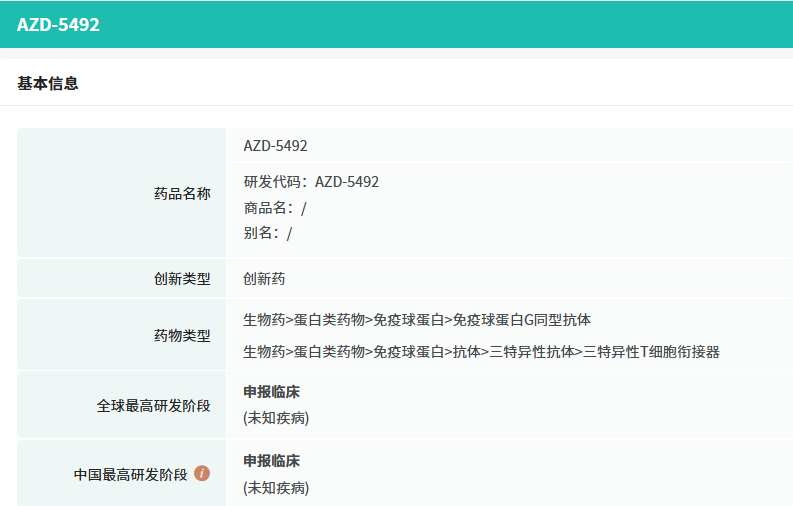
AZD5492是一款CD20×TCR×CD8三特异性抗体,为CD8引导的T细胞衔接器剂,首次在中国获批临床。B细胞恶性肿瘤源于B淋巴细胞异常增殖,包括多发性骨髓瘤、淋巴瘤等。
截图来源:摩熵医药全球药物研发数据库
2024年8月14日AZD5492在中国申报临床,它是一种不对称三特异性IgG1抗体,含两抗CD20 Fab结构域、一TCR结合VHH结构域和一CD8共受体结合VHH结构域。抗CD20抗体常用于B细胞疾病治疗。
截图来源:摩熵医药全球药物研发数据库
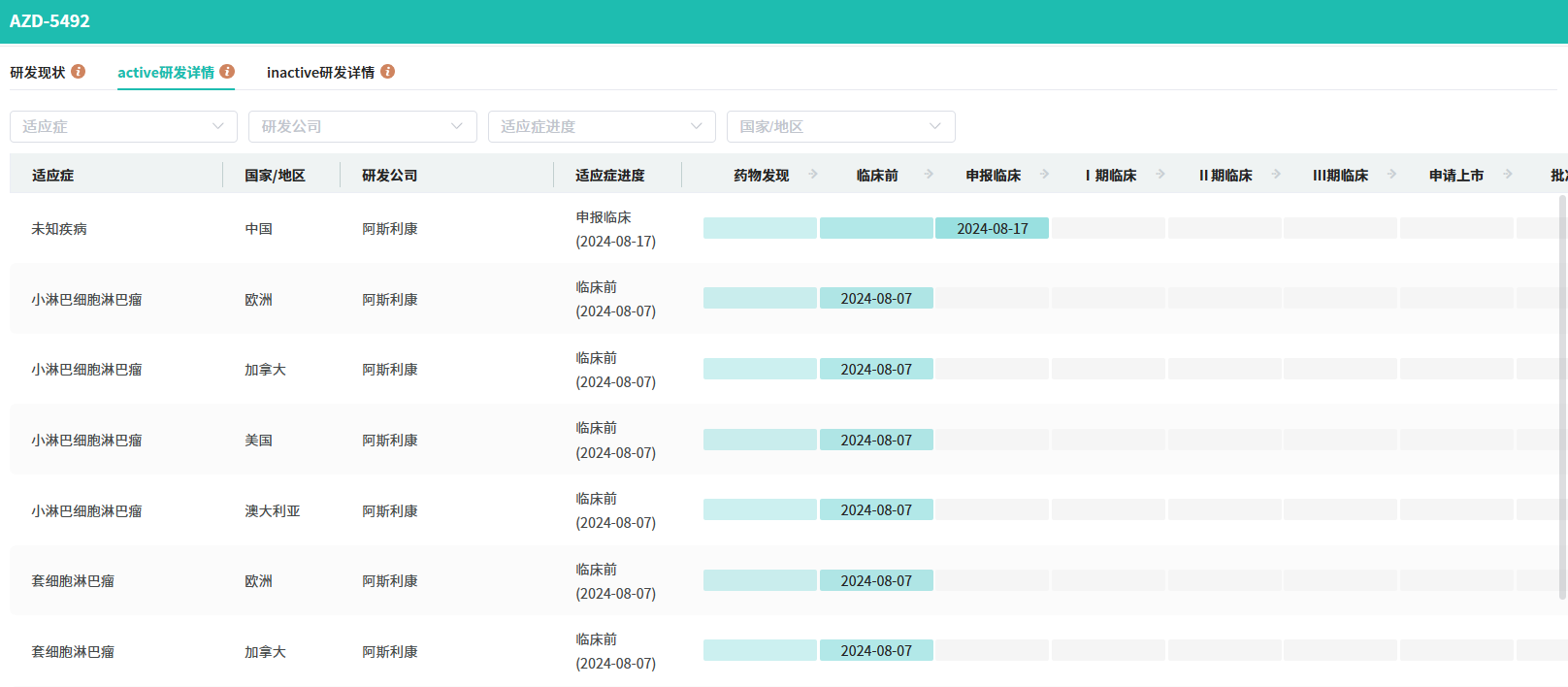
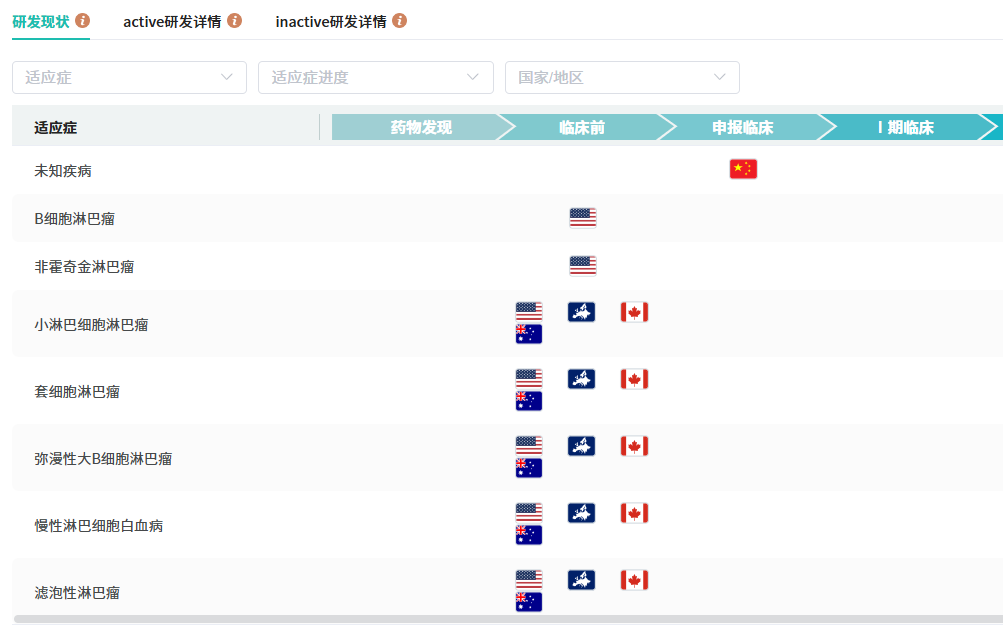
在2024欧洲血液学协会年会上,AZD5492治疗B型非霍奇金淋巴瘤的临床前研究数据被公布,显示其通过优先连接CD8+T细胞诱导B细胞杀伤,减少CD4+T细胞活化,有望提高B细胞淋巴瘤治疗效果。目前研发现状,AZD5492在美国、加拿大、澳大利亚处于临床前阶段。
截图来源:摩熵医药全球药物研发数据库
此次AZD5492在中国获得临床批准,标志着这款新药即将在中国启动临床研究。
参考来源:
[1] CDE官网
[2] 摩熵医药(原药融云)数据库
<END>
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论