
10月10日,恒瑞医药宣布其注射用紫杉醇(白蛋白结合型)的ANDA(简略新药申请,即美国仿制药申请)已获FDA批准,是首家在美国获得该品种仿制药批准的厂家。

据了解,白蛋白紫杉醇是紫杉醇与白蛋白结合的全新制剂,由Abraxis BioScience原研,商品名为Abraxane。该药于2005年1月获美国FDA批准上市,于2008年6月进入中国,用于治疗乳腺癌。上市多年来,白蛋白紫杉醇获得国内外多个权威指南推荐,成为乳腺癌、非小细胞肺癌、胰腺癌、胃癌等癌种的化疗基础用药。
2010年,新基通过收购Abraxis,将白蛋白紫杉醇收入囊中。2019年,BMS完成对新基的收购,白蛋白紫杉醇又顺其自然地成为BMS旗下产品。白蛋白紫杉醇在国内的商业化推广也颇具看点,2017年7月,百济神州宣布接手新基在中国的商业团队,并获得新基在华获批数个产品的商业化独家授权。白蛋白紫杉醇就是其中之一,这一授权的协议期限为10年。
不过,随着白蛋白紫杉醇专利的到期,国内药企都开始瞄准了仿制药的机会。2018年2月,石药集团的艾力克率先获批上市;2018年8月,恒瑞医药的艾越获批上市;2019年11月,齐鲁制药的齐鲁锐贝也获批上市。这给了国家医保局开展集采的机会。
2020年1月21日第二轮全国带量采购中,恒瑞医药、石药集团、新基分别以780元/支、747元/支和1150元/支的价格中标。百济神州通过报价策略,成功挤入了集采名单,希望保住原研药的市场份额。
然而好景不长。百济刚争取到中选资格不久,国家药监局跨境飞检就查出新基工厂无菌保障措施不到位。白蛋白紫杉醇这一国内市场数十亿级大品种的前景,在2020年3月戛然而止。
从2020年3月25日起,新基的白蛋白紫杉醇被暂停进口、销售和使用,这款进口药成为首个被取消国采资格的产品。在被暂停进口和销售后,联采办也同步取消了新基的白蛋白紫杉醇的中选资格。随着新基白蛋白紫杉醇“退出”全国带量采购,石药欧意与恒瑞医药顺理成章地瓜分了原研药的市场。
当时有业内人士表示,“白蛋白紫杉醇在抗肿瘤领域使用量非常大,全球生产这款药物的企业也很多,目前市场竞争十分激烈,在这种情况下,百济神州被叫停该药品将会直接失去大半市场。”此后,百济神州与新基的合作也以分手告终。
2024年5月10日,国家药监局官网发布公告,恢复进口、销售、使用百时美施贵宝子公司新基制药的白蛋白注射用紫杉醇。但摆在新基面前的,是一个相当残酷的竞争局面:失去的市场份额,已在过去几年被国内仿制药产品完全抢占。
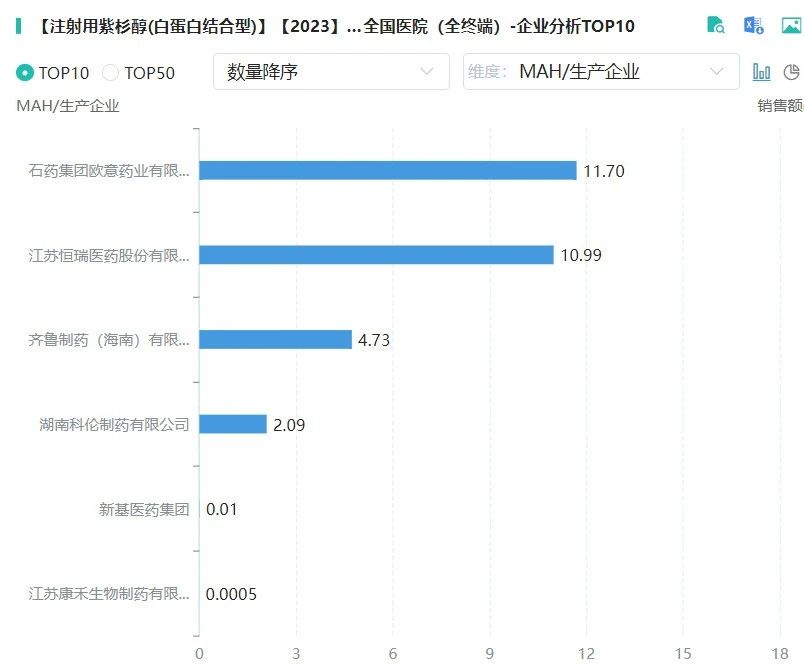
截图来源:摩熵医药(原药融云)数据库
恒瑞医药注射用紫杉醇(白蛋白结合型)于2018年8月在国内获批上市,用于治疗联合化疗失败的转移性乳腺癌或辅助化疗后6个月内复发的乳腺癌。2024年8月获批第二项适应症,用于联合吉西他滨作为转移性胰腺癌的一线治疗。
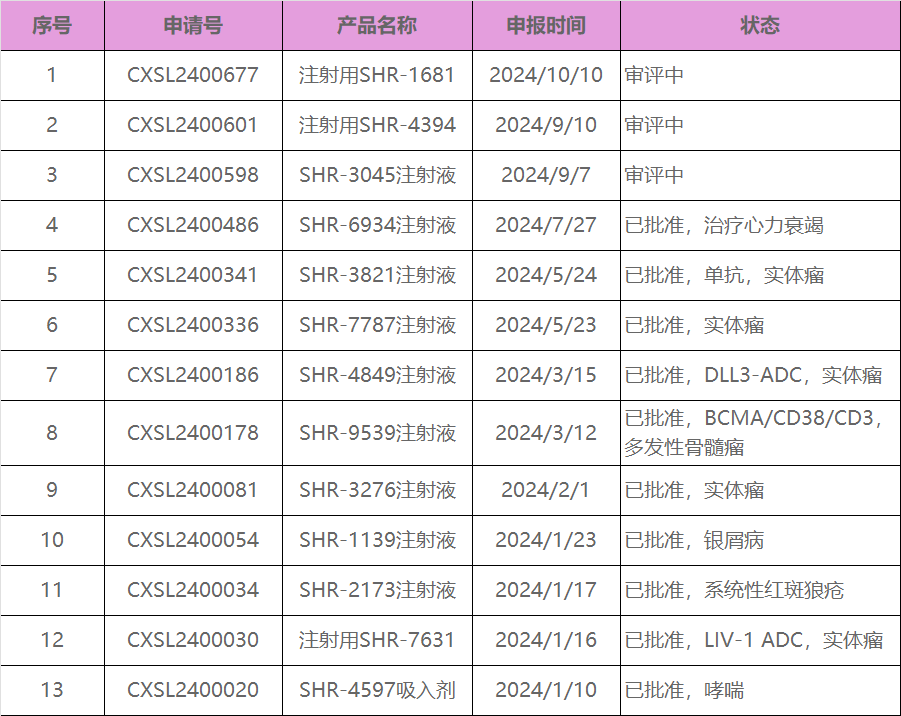
10月10日,恒瑞医药白蛋白紫杉醇在美国获批上市,成为首家在美国获得该品种仿制药批准的厂家。同日,恒瑞本年度第13款大分子药物:SHR-1681,获得了CDE受理。
2024年10月10日,根据CDE官网显示,受理了恒瑞医药递交的一类新药SHR-1681的临床试验申请,从研发序号来看应为2016年立项的项目。

这也是恒瑞医药本年度递交的第13款大分子药物IND申请,截止到目前恒瑞医药今年已经获批10款药物进入临床,3款还在审批中。
恒瑞医药以fast-follow著称,在创新药加剧发展的极端,一度认为恒瑞的研发模式将遭到淘汰,但是随着创新药逐步过渡到临床阶段,确定性又成为药物研发主要的关注点,恒瑞的模式显然还具有竞争力。
参考来源:企业官方公告、药融云数据库、医药魔方、健识局、 UmabsDB
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论