据CDE官网,近日恒瑞医药又有一1类新药的临床申请获受理,为HRS-5041片。据悉,此次是该药首次申报。至此,恒瑞医药2023年共有19款1类新药申报临床,与此同时,今年恒瑞医药已有5款1类新药获批临床(默示许可),其中3款均为抗肿瘤药物。
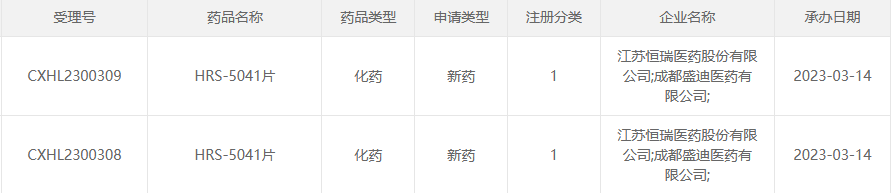
截图来源:CDE官网
恒瑞医药2023年获批临床(默示许可)的1类新药(统计截止2023.3.15)
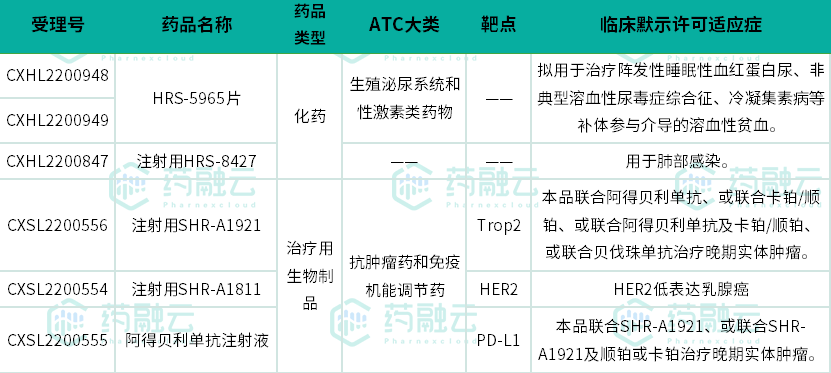
数据来源:药融云中国药品审评数据库
一、HRS-5965片
2023年3月10日,恒瑞医药递交的HRS-5965片1类新药获批临床,适应症为阵发性睡眠性血红蛋白尿、非典型溶血性尿毒症综合征、冷凝集素病等补体参与介导的溶血性贫血。在之前的临床研究中,该药物申请的适应症为用于IgA肾病、特发性膜性肾病、C3肾病和狼疮性肾炎等补体参与介导的原发性或继发性肾小球疾病。HRS-5965片可改善免疫复合物沉积导致的肾小球炎症。在临床前大鼠肾炎模型中,该新药显示出显著的治疗潜力,且安全性良好。
HRS-5965适应症研发现状(微信搜索"药融云小程序"进行相关更多数据查询)
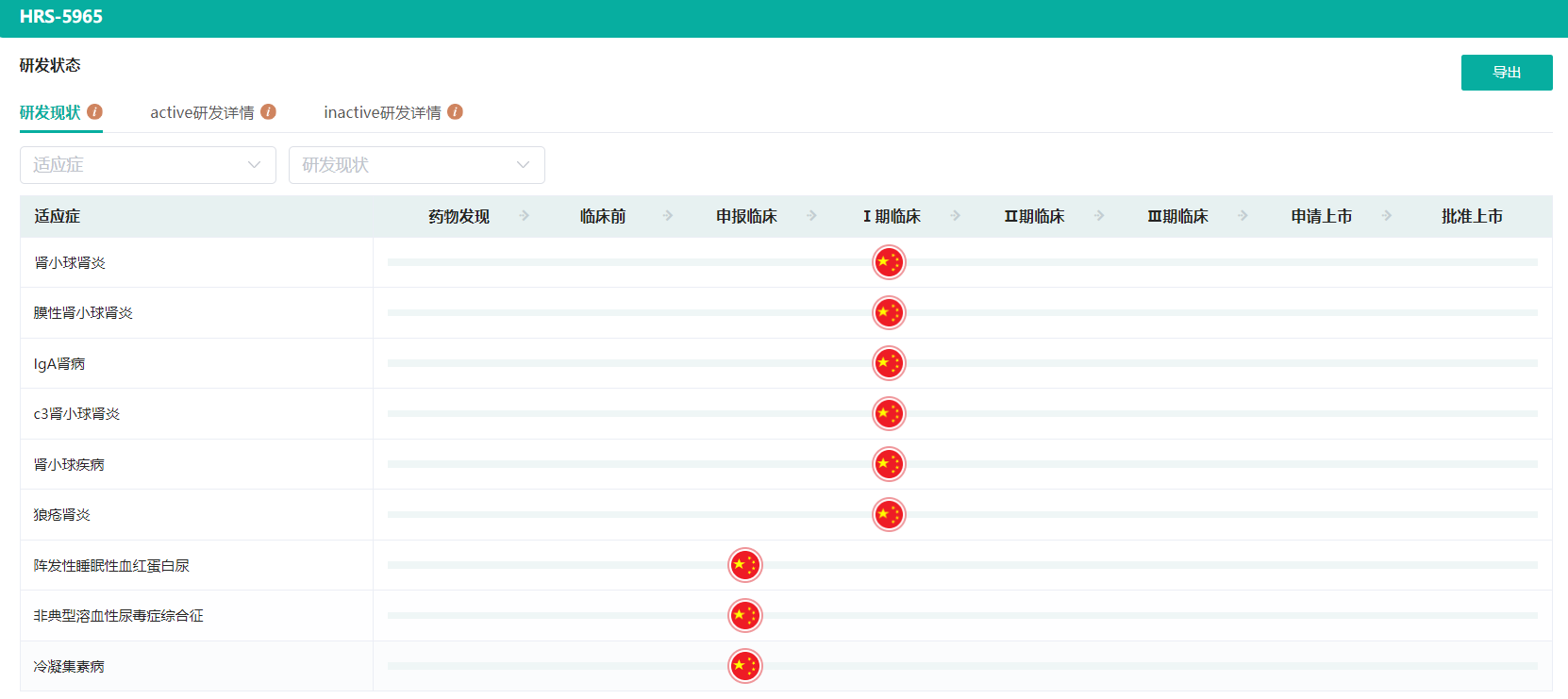
截图来源:药融云全球药物研发数据库
二、注射用HRS-8427
注射用HRS-8427通过抑制细胞壁的生物合成发挥抑菌杀菌作用,临床前显示其在多个标准菌株和临床分离菌株构建的小鼠感染模型中发挥抗菌药效,安全性良好。目前,国内暂无同类产品获批上市。
HRS-8427曾于2022年7月首次被批准针对尿路感染的临床试验,彼时恒瑞医药透露该产品的相关项目累计已投入研发费用约3307万元。同年8月,恒瑞医药启动了注射用HRS-8427一项I期临床试验,目的是评估其在健康受试者中单、多次给药后的安全性、耐受性以及药代动力学。据药融云数据库,3月6日,HRS-8427在中国肾功能不全受试者中的多中心、平行、开放的药代动力学和安全性研究启动(登记号:CTR20230658)。
HRS-8427临床试验信息(部分)
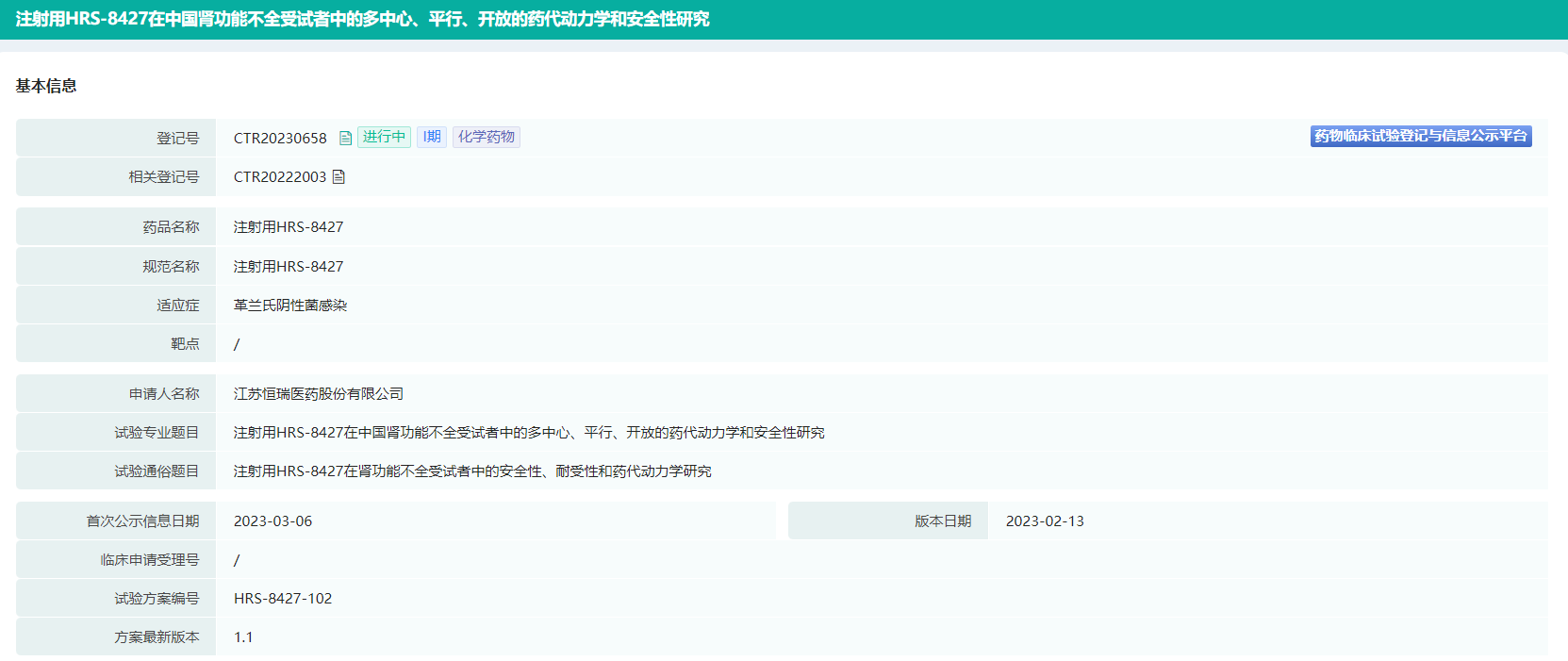
截图来源:药融云中国临床试验数据库
三、ADC药物研发喜讯不断
据药融云数据库显示,恒瑞医药是国内ADC药物管线最丰富的企业之一,从2010年开始做ADC平台,目前已有SHR-A1811、SHR-A1201、SHR-A1403等近10款1类新药获批临床。今年恒瑞医药共有SHR-A1921和SHR-A1811两款ADC药物获批临床(默示许可)(《国内ADC药物研发火热!恒瑞医药8款在研,捷报频传》)。
其中,SHR-A1811进展最快,针对转移性乳腺癌的研究已进入临床III期阶段,还于2月10日获得2个拟纳入突破性疗法认定,用于HER2阳性的复发或转移性乳腺癌患者;用于HER2低表达的复发或转移性乳腺癌患者。
注射用SHR-A1811是恒瑞医药自主研发的、以HER2为靶点的抗体药物偶联物,可通过与HER2表达的肿瘤细胞结合并内吞,在肿瘤细胞溶酶体内通过蛋白酶剪切释放毒素,诱导细胞周期阻滞从而诱导肿瘤细胞凋亡。SHR-A1811目前已开展多项Ⅰ~Ⅲ期临床研究,涵盖HER2表达或突变的晚期实体瘤、晚期胃癌或胃食管结合部腺癌、结直肠癌、晚期非小细胞肺癌、转移性乳腺癌等。
注射用SHR-A1921也为恒瑞医药自主研发和生产的ADC药物,通过与肿瘤细胞表面的靶抗原结合,使得药物被内吞进入细胞后释放小分子毒素杀伤肿瘤细胞,SHR-A1921治疗晚期实体瘤的I期临床研究正在开展中。截至2023年2月14日,注射用SHR-A1921相关研发项目累计已投入研发费用约为4,894万元。
四、阿得贝利单抗:国产第3款PD-L1
阿得贝利单抗是恒瑞医药自主研发的人源化抗PD-L1单克隆抗体,能通过特异性结合PD-L1分子从而阻断导致肿瘤免疫耐受的PD-1/PD-L1通路,重新激活免疫系统的抗肿瘤活性,从而达到治疗肿瘤的目的。
本次作为1类新药获批临床,是拟用于联合SHR-A1921、或联合SHR-A1921及顺铂或卡铂治疗晚期实体肿瘤。现有多项阿得贝利单抗注射液临床研究正在进行中,以评估其在各类实体肿瘤的抗肿瘤作用。
阿得贝利单抗临床试验开展情况

截图来源:药融云中国临床试验数据库
2022年1月,阿得贝利单抗联合化疗一线治疗广泛期小细胞肺癌的药品上市许可申请获药监局受理。2023年2月底,阿得贝利单抗获NMPA批准上市,联合依托泊苷+卡铂用于广泛期小细胞肺癌(ES-SCLC)一线治疗。这是国产第3款PD-L1单抗,也是恒瑞医药第12款获批上市的1类新药。
参考来源:
[1] CDE官网
[2] 药融云数据库
[3] 恒瑞医药官方披露
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论