
9月24日,Amgen宣布其OX40单抗rocatinlimab用于治疗特应性皮炎的III期试验和已获批上市的CD19抗体Uplizna在用于重症肌无力的III期试验中均取得成功。
rocatinlimab
AMG 451(rocatinlimab)是一款全人源化抗OX40单克隆抗体在研新药,安进通过一项高达12.5亿美元的合作获得了共同开发和商业化该产品的权益。
Horizon研究是安进公司正在进行的有关rocatinlimab八项III期试验中的第一项,此外围绕rocatinlimab的研究还覆盖特应性皮炎、哮喘、结节性痒疹等多个适应症。

HORIZON研究(NCT05651711)中共入组726例特应性皮炎患者,按3:1随机分组接受Rocatinlimab单药或安慰剂治疗,主要终点为治疗24周的EASI-75和fIGA 0/1,旨在评估Rocatinlimab 单药治疗中度至重度特应性皮炎 (AD) 成年患者的疗效、安全性和耐受性。
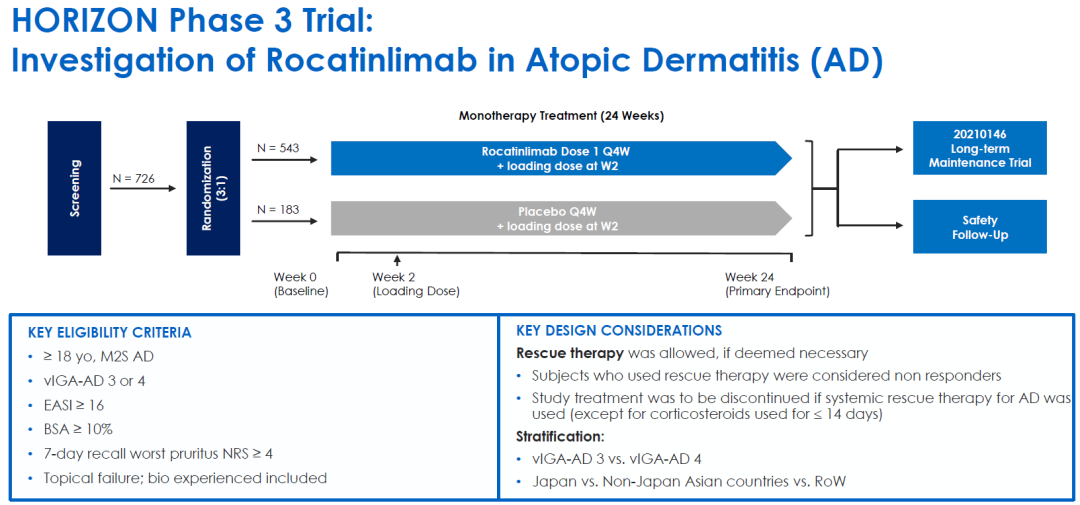
rocatinlimab达到了主要终点,所有次要终点也都有显著的统计学意义。24周后,32.8%的患者的湿疹面积和严重程度指数(EASI-75)至少下降了75%,而服用安慰剂的患者只有13.7%;治疗组rIGA 0/1响应率为16.4%,安慰剂组为4.9%。总体安全性结果与2b期试验相似。

rocatinlimab的成功将巩固安进相对于赛诺菲amlitelimab的优势,赛诺菲将amlitelimab定位为其转向免疫学的主要增长动力之一。但该药的首个III期临床试验要到2026年底才能完成。与此同时,安进至少还有四项rocatinlimab的III期临床试验预计将在明年七月前报告数据,包括不同剂量的研究、该药物作为联合或维持疗法的使用,以及一项针对青少年的试验。

Uplizna
其罕见病药物Uplizna在治疗自身免疫性疾病重症肌无力的3期试验中达到了主要终点和关键次要终点。
Uplizna是一款对CD19具有高度亲和力的人源化单克隆抗体。CD19表达在多类B细胞上,其中包括分泌抗体的成浆细胞(plasmablasts)和浆细胞。通过与CD19抗原结合,Uplizna能够迅速将这些细胞从血循环中清除,从而降低自身抗体的产生,缓解患者症状。它最初由Viela Bio公司开发,在2020年首次获得FDA的批准,治疗视神经脊髓炎谱系疾病(NMOSD)患者。

MINT研究中共入组238例全身性重症肌无力患者,按1:1随机分组接受Uplizna单药或安慰剂治疗,主要终点为总体研究人群第26周时重症肌无力日常活动量表(MG-ADL)评分与基线相比的变化。

该研究达到了主要终点,与安慰剂相比,在第26周服用两剂UPLIZNA后,MG-ADL评分有临床意义和统计学意义的改善:总体改善-4.2,安慰剂调整后-1.9(p<0.0001)。也达到了次要终点,与安慰剂相比,在第26周服用UPLIZNA后,QMG评分有统计学意义的改善:总体改善-4.8,安慰剂调整后-2.5(p = 0.0002)。正在按方案评估其他疗效、反应持久性和安全性,未发现新的安全性信号,安进即将启动监管申报活动。
此前6月,MITIGATE 3期研究在IgG4-RD领域取得了令人瞩目的成果,这是全球首例达到主要终点的IgG4-RD随机对照试验。与安慰剂相比,52周时IgG4-RD复发风险降低了87%,具有临床意义和统计学意义(HR=0.13, p < 0.0001)。经多重性调整后,所有三个关键次要终点均达到统计学意义,首次给药后的给药间隔为 6个月,非常方便;采用类固醇间隔研究设计,以减少类固醇负担和毒性,未发现新的安全性信号。安进计划首先向美国FDA递交监管申请,随后在其他国家和地区递交监管申请以扩展Uplizna的适应症。
参考资料:公司公告
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论