
9月15日,阿斯利康在2024欧洲肿瘤内科学会(ESMO)上公布了其重磅PD-L1靶向抗体Imfinzi(durvalumab)联合化疗联合治疗肌层浸润性膀胱癌(MIBC)的NIAGARA Ⅲ期试验(NCT03732677)的积极结果。与新辅助化疗相比,在无事件生存期 (EFS) 的主要终点和总生存期 (OS) 的关键次要终点方面表现出统计学上显著且临床上有意义的改善。
Imfinzi是一种人源化单克隆抗体,可与PD-L1蛋白结合并阻断PD-L1与PD-1和 CD80蛋白的相互作用,从而对抗肿瘤的免疫逃避策略并释放对免疫反应的抑制。

NIAGARA是一项随机、开放标签、多中心、全球性III期试验,评估Imfinzi作为MIBC患者根治性膀胱切除术前后的治疗方法。在该试验中,1063名患者被随机分配在膀胱切除术前接受Imfinzi联合化疗或单独化疗组,术后接受Imfinzi治疗或不再接受治疗。该试验在美国、加拿大、欧洲、澳大利亚和亚洲等22个国家的192个中心进行。其主要终点是无事件生存期(EFS ),即从治疗随机化开始到肿瘤复发或进展以及病理完全反应等事件发生的时间。关键的次要终点是OS和安全性。
预定的期中分析显示,接受Imfinzi围手术期方案治疗的患者与对照组相比,疾病进展、复发、进一步手术或死亡的风险降低了32%(基于EFS的危险比[HR]为0.68;95%置信区间[CI]为0.56-0.82;P<0.0001)。Imfinzi治疗组的预计中位EFS尚未达到,而对照组为46.1个月。预计接受Imfinzi方案治疗的患者在两年时无事件率为67.8%,而对照组为59.8%。
关键次要终点OS的结果显示,Imfinzi围手术期方案与新辅助化疗和根治性膀胱切除术相比,死亡风险降低了25%(基于OS的HR为0.75;95% CI为0.59-0.93;P=0.0106)。两组的中位生存期均未达到。预计接受Imfinzi方案治疗的患者2年时的生存率为82.2%,而对照组的生存率为75.2%。
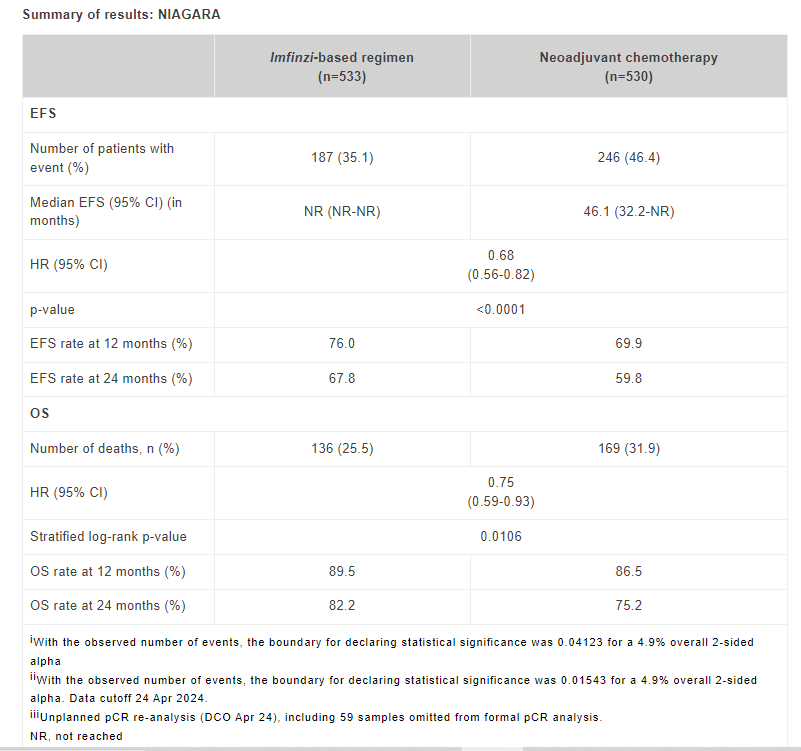
Imfinzi的耐受性总体良好,未发现新的安全性信号。在接受Imfinzi治疗的患者中,有69%的患者发生了任何原因导致的3级和4级不良事件,在接受新辅助化疗的患者中,有68%的患者发生了此类不良事件。
除NIAGARA外,Imfinzi还在早期和晚期膀胱癌的各种治疗组合中进行测试,包括非肌肉浸润性疾病(POTOMAC)、不符合顺铂条件或拒绝顺铂的MIBC患者(VOLGA)以及局部晚期或转移性疾病(NILE)。
此前8月17日,阿斯利康宣布Imfinzi(durvalumab)联合化疗获FDA批准用于治疗可切除、早期(IIA-IIIB)非小细胞肺癌(NSCLC)成人患者,这些患者的肿瘤无已知的表皮生长因子受体(EGFR)突变或间变性淋巴瘤激酶(ALK)重排。在该方案中,患者在手术前接受Imfinzi联合新辅助化疗治疗,并在手术后接受Imfinzi单药辅助疗法。之前的3期试验结果显示,接受基于Imfinzi方案治疗患者的病理学完全缓解(pCR)率是对照组的4倍。
参考资料:公司公告
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论