
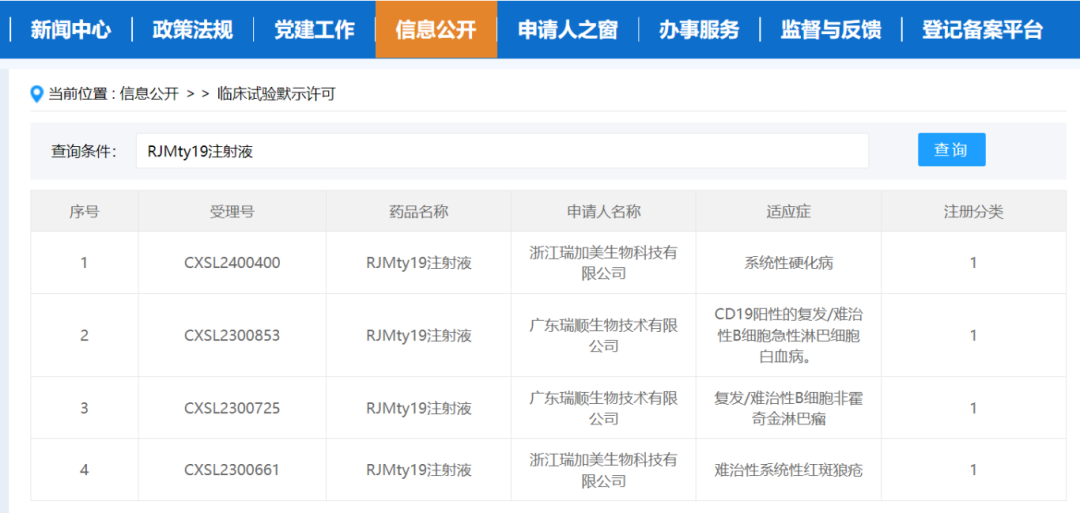
近日,据CDE官网公示,广东瑞顺生物技术有限公司(下称“瑞顺生物”)申报的RJMty19注射液的新药临床试验(IND)申请获国家药品监督管理局(NMPA)药品审评中心(CDE)默示许可,拟用于治疗系统性硬化病。这款候选产品此前已获批3项默示许可。
系统性硬化病(SSc)是一类以皮肤纤维化为主要特征的多脏器受累的自身免疫性结缔组织病。除皮肤受累外,也可影响内脏(肺、心血管、肾脏、消化道等)。SSc的发病高峰在45~65岁之间,儿童发病相对少见,女性好发,男女比例约1∶4~1∶6,而男性患者往往病情较重,更容易表现出弥漫性皮肤病变、指端溃疡和肺动脉高压,预后相对较差。
RJMty19注射液(主要活性成分为CD19-CAR-DNT细胞)由广东瑞顺生物技术有限公司基于人源化CD19-CAR全球专利开发的一款全球创新现货通用型第二代DNT细胞治疗产品。与目前已上市的7款自体CD19-CAR-T细胞治疗产品相比,健康捐赠者来源的CD19-CAR-DNT细胞具有可实现标准化制备、制备成本低、患者即时可用等诸多优点,未来市场竞争潜力巨大,可从根本上改变目前自体CAR-T细胞产品商业化推广的劣势。
DNT(Double Negative T,双阴性T)细胞是指人外周血中正常存在的 CD3+CD4-CD8-的 T细胞亚群,占T细胞总数 1-10%。DNT 细胞表面表达 CD3 分子和αβ- 或γδ-T细胞受体 (T Cell Receptor,TCR),不表达 CD4 和 CD8 分子,也不结合恒定型自然杀伤 T (invariant Nature Killer T, iNKT)细胞特异性αGalCer 加载的 CD1d 四聚物,因此不同于常规的T细胞、NK细胞和NKT细胞。
DNT细胞高表达NKG2D、DNAM-1等细胞表面受体,以 MHC 非限制性的方式特异性识别表达相应配体的肿瘤细胞,通过分泌多种细胞毒分子和细胞因子实现对肿瘤细胞的杀伤,但不引起移植物抗宿主病 (GvHD)和宿主抗移植物反应(HvGR)。
广东瑞顺生物技术有限公司以“关爱生命,造福人类”为愿景,以“做老百姓用得起的创新细胞药”为使命,专注于研发以DNT细胞为核心技术平台的现货通用型免疫细胞产品,是全球范围内DNT细胞免疫疗法的开创者,已开发了多款基于DNT细胞技术平台的现货通用型细胞治疗产品,包括RC1012注射液、RJMty19注射液等。
参考来源:公开披露信息
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论