
2024年6月12日 ,Ultragenyx公司宣布与美国食品和药物管理局(FDA)达成一致意见,认为脑脊液(CSF)中的硫酸乙酰肝素(HS)是一个合理的替代终点,可以支持加速批准其在研AAV基因疗法UX111 (ABO-102) 治疗IIIA型黏多糖贮积症(MPS IIIA)的生物制品许可申请(BLA)。该公司需要在BLA前会议上与该机构敲定BLA的细节,以便在今年年底或明年年初提交申请。

正如与FDA所讨论的那样,BLA申请将以现有数据为基础,包括正在进行的 Transpher A关键性研究的数据,该研究评估了UX111对MPS IIIA儿童的安全性和有效性。2024年2月初,该公司公布了Transpher A临床1/2期研究新的积极数据,该研究评估了UX111在患有MPS IIIA的儿童中的安全性和有效性,显示单次输注UX111可以显著纠正潜在的代谢疾病,并维持几乎所有患者的认知功能。此外,观察到的脑脊液中硫酸乙酰肝素暴露的减少可以预测UX111治疗后MPS IIIA患者的长期认知功能的改善。

UX111是一种新型体内基因疗法,目前正处于针对MPS IIIA的1/2/3期临床开发阶段。UX111旨在使用AAV9载体,递送SGSH基因的功能性拷贝到中枢神经系统和外周器官,从而弥补SGSH酶的缺失。SGSH酶的缺失导致硫酸乙酰肝素在大脑和身体其它部位累积,从而导致渐进性细胞损伤和神经退行性变的问题。UX111项目在美国获得了再生医学高级疗法、快速通道、罕见儿科疾病和孤儿药称号,在欧盟获得了 PRIME和孤儿药称号。
MPS IIIA是一种常染色体隐性遗传病,由编码N-磺基葡萄糖胺磺基水解酶(SGSH)的基因发生突变所引起。SGSH酶可分解并回收HS。HS调控着一系列重要的生理过程,但是当编码SGSH的基因发生突变而导致酶失活时,HS会在器官中积聚并破坏器官的正常功能,特别是造成中枢神经系统的功能损伤,患者可能出现发育迟缓、行为障碍、癫痫发作等认知或生理异常状况。
Ultragenyx公司首席执行官兼总裁、医学博士Emil D. Kakkis博士说:"美国FDA认定CSF HS是一种相关的生物标记物,从而加快了Sanfilippo综合征的审批速度,这对社区来说是一个关键时刻,为治疗所有致命类型的神经病理粘多糖病铺平了道路。我们感谢患者和护理人员的支持者、科学家和行业领导者的分享与合作,他们提供了支持这一重要决定所需的全面证据。"
关于Ultragenyx Pharmaceutical
Ultragenyx Pharmaceutical(纳斯达克股票代码:RARE)于2010年在硅谷成立,是一家专注于罕见病药物研发与商业化美国生物技术公司。经过2轮融资后,于2014年成功在纳斯达克上市。(截至2024年3月8日,该公司股价50.53美元/股,市值约41.6亿美元。3月26日,市值为37.43亿美元。)其创始人、总裁兼首席执行官Emil Kakkis曾在Harbour-UCLA医疗中心工作,并开发一种针对罕见疾病MPS I 的酶替代疗法。
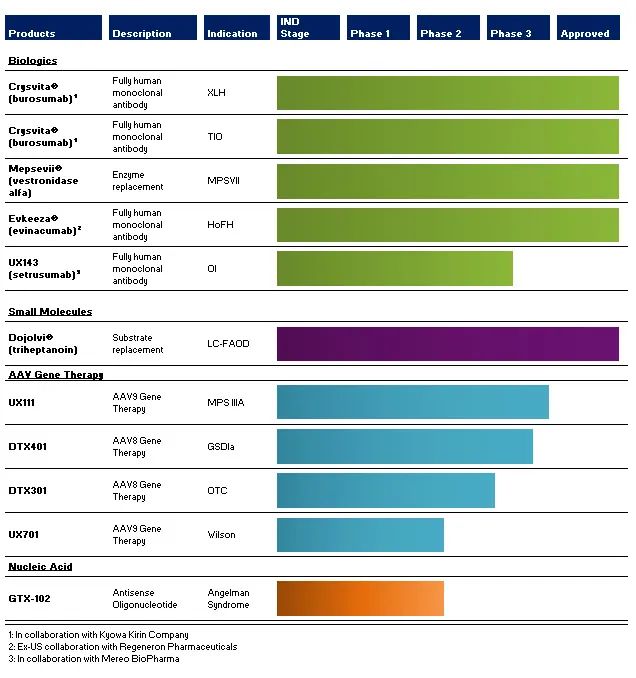
Ultragenyx目前批准的疗法和临床阶段的产品线包括四个产品类别:生物制剂、小分子、AAV基因疗法和核酸候选药物,有四种已获商业上市批准的产品:用于治疗X-连锁低磷血症(XLH)和肿瘤诱导的骨软化症(TiO)的Crysvita®(burosumab)、用于儿童和成年人黏多糖贮积症VII型(MPSVII)或SLY综合征的Mepsevii®(vestronidase Alfa)、用于治疗长链脂肪酸氧化障碍(LC-FAOD)的Dojolvi®(triheptanoin)和用于治疗家族性高胆固醇血症(HoFH)的Evkeeza®(evinacumab)。
总结
腺相关病毒(AAV)已成为基因治疗的首选递送载体,也被公认为目前最有前景的递送载体,截止目前,全球已获批上市的AAV基因疗法共有8款。
国内布局AAV基因疗法的公司有中因科技、方拓生物、天泽云泰、至善唯新、康弘药业、嘉因生物、锦篮基因、朗信生物、信念医药、纽福斯、九天生物、瑞宏迪医药、克睿基因、瑞吉康、凌意生物等。国内有30余款AAV基因治疗药物IND申报获批,其中今年获批的产品有:瑞吉康的RJK002注射液用于渐冻症、天泽云泰VGN-R09b用于治疗原发性帕金森病和芳香族L-氨基酸脱羧酶缺乏症、凌意生物LY-M001用于治疗I型或III型戈谢病。
参考来源:公司官网
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论