
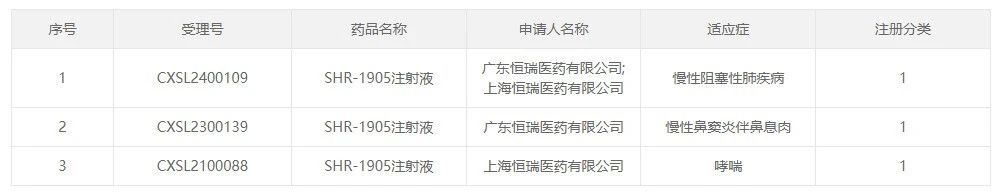
近日,江苏恒瑞医药股份有限公司子公司广东恒瑞医药有限公司收到国家药品监督管理局(以下简称“国家药监局”)核准签发关于SHR-1905 注射液的《药物临床试验批准通知书》,适应症为慢性阻塞性肺疾病,将于近期开展临床试验。
SHR-1905注射液是胸腺基质淋巴细胞生成素(TSLP)单克隆抗体,可以阻断炎症细胞因子的释放,抑制下游炎症信号的传导,最终改善炎症状态并控制疾病进展。经查询,目前国内外尚无同类药物获批用于慢性阻塞性肺疾病的治疗。截至目前,SHR-1905注射液相关项目累计已投入研发费用约7866万元。

截图来源:药融云全球药物研发数据库
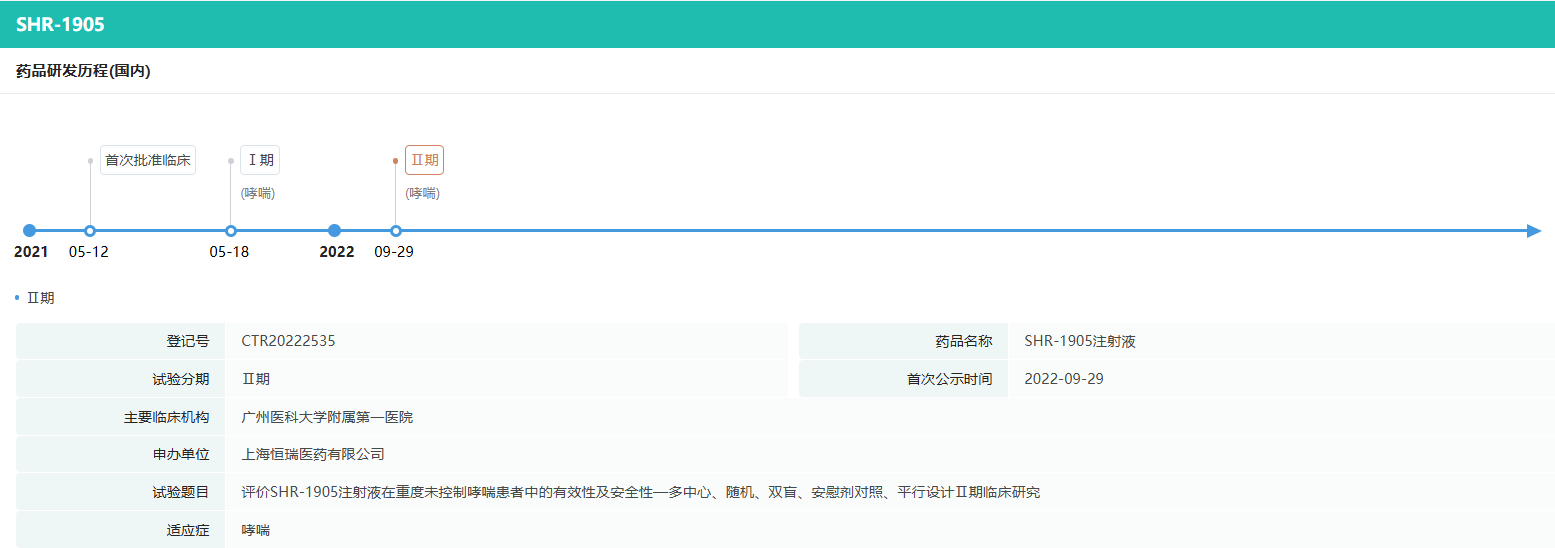
除慢性阻塞性肺疾病外,SHR-1905于2021年5月获得国家药品监督管理局批准开展用于哮喘的临床试验,2023年5月获批开展慢性鼻窦炎伴鼻息肉适应症的临床试验。
截图来源:药融云全球药物研发数据库
2023年8月,恒瑞医药宣布与美国 One Bio公司达成协议,将具有自主知识产权的 1 类新药SHR-1905注射液项目有偿许可给 One Bio。其中包括2150万美元的首付款和为SHR-1905的首个海外临床Ⅱ 期试验提供一定数量的样品后获得的350万美元的近期里程碑付款。后续研发及销售里程碑款最高达10.25亿美元,销售额提成两位数。
参考来源:公司公告
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)










 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论