
自2010年,来自美国贝纳罗亚研究所的科学家Steven F. Ziegler博士团队首次表明了TSLP(胸腺基质淋巴细胞生成素)参与启动导致哮喘等过敏性疾病发展的炎症级联反应,直到2018年国际科学期刊Science Signaling将TSLP可用作儿童哮喘等过敏性疾病的治疗靶点作为其封面故事,TSLP自身免疫病中的关键作用逐渐浮出水面。
近期,多则关于TSLP靶点的临床和市场消息吸引人们关注。今年8月,恒瑞医药将TSLP单抗SHR-1905在大中华地区以外的权益授权给One Bio(Aiolos Bio),凭借该管线One Bio完成2.45亿美元的巨额A轮融资。同月,创新生物技术公司博奥信在美国完成TSLP单抗Bosakitug(博奥信项目号BSI-045B/正大天晴项目号TQC2731)针对特应性皮炎的临床II试验首例患者入组。6月,美国免疫药物开发商Upstream Bio完成2亿美元的B轮融资,用于继续推进研究性TSLP抗体药物UPB-101(ASP-7266)治疗哮喘和慢性鼻窦炎伴鼻息肉的II期临床研究。
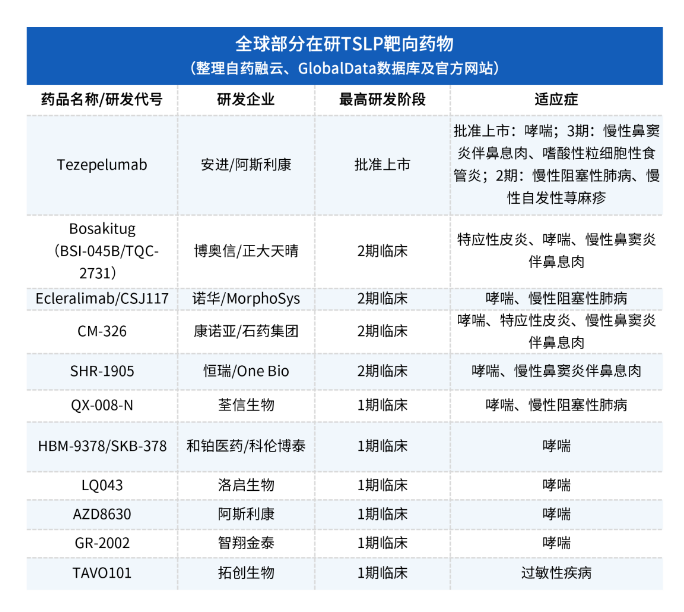
根据药融云统计,目前全球范围内已有不少企业加入到TSLP靶点药物开发赛道中,包括安进、诺华、阿斯利康,以及博奥信/正大天晴、康诺亚/石药集团、和铂医药/科伦博泰、荃信生物、智翔金泰等等。TSLP靶点正吸引着越来越多的入局者,其背后蕴藏的正是自身免疫病领域庞大的未满足需求。
接连达成重磅交易,靶点价值几何?
自身免疫性疾病是全球范围内药物开发的热门赛道,催生了许多重磅炸弹药物,例如蝉联“药王”宝座11年的修美乐(阿达木单抗)。根据弗若斯特沙利文报告,全球自身免疫性疾病药物市场在2021年达到1277亿美元,估计在2030年将达到1760亿美元。
其中,特应性皮炎(AD)是自免领域最常见的慢性炎症瘙痒性疾病之一,尤其是对于儿童。全球范围内,15%~30%的儿童和2%~10%的成人受到特应性皮炎的影响,并在过去30年间患病率逐渐增加,在非致命性皮肤疾病中疾病负担位列第一。《中国特应性皮炎患者生存状况调研报告》显示,超过75%的医生对现有治疗方案不满意,患者需要更加方便、安全、长期的治疗方案。这给靶向生物制剂提供了一个绝佳的机遇以及市场发展空间。
据统计,全球特应性皮炎药物获批准处方产品市场由2015年的44亿美元增至2019年的79亿美元。受当前已获批以及其他即将上市的生物药推动,预期该市场将于2030年进一步增至234亿美元。
作为一种多效细胞因子,胸腺基质淋巴细胞生成素(TSLP)随着研究的越来越深入,研究人员发现TSLP与多种自身免疫性疾病、慢性炎症性疾病、过敏性疾病以及癌症的发病有着密切关系,如哮喘、特应性皮炎、食物过敏等。因此TSLP抗体药物具有广阔的市场应用前景,有望成为自身免疫疾病领域的重要靶点之一。
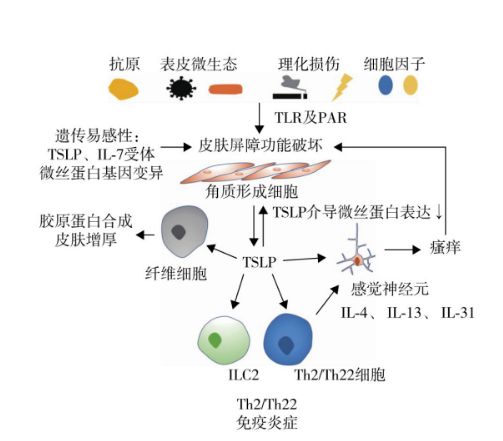
▲TSLP在特应性皮炎的机制
图源:中华临床免疫和变态反应杂志
目前,全球范围内仅有阿斯利康/安进的TSLP单抗TezspireTM(tezepelumab)获批,药融云数据库显示,该药已在美国、欧盟、日本被批准用于治疗严重哮喘,2023年上半年销售额约2.3亿美元。该药曾被Evaluate Pharma评为2022年度最值得期待的全球TOP10上市新药之一,预计2026年销售额达到20亿美元。正是凭借广阔的市场前景,TSLP管线帮助One Bio(Aiolos Bio)与Upstream Bio拿下巨额投资。
不做Follower,国产TSLP单抗探索差异化创新
不过,虽然TSLP靶点前景广阔,但开发新药的道路颇为曲折,默沙东、罗氏、安斯泰来在TSLP靶点相继折戟。可见针对这一靶点的药物开发并不容易,考验着企业的研发实力。
因此面对TSLP这个重量级靶点,国内诸多企业在全球TSLP靶点药物开发赛道中都采取差异化创新,试图开发出具有竞争力的创新药物。
博奥信/正大天晴(Bosakitug:BSI-045B/ TQC2731)
由全球化创新生物技术公司博奥信与正大天晴合作开发的TSLP抗体Bosakitug是目前国际上较为领先的TSLP单抗。目前,博奥信正在美国进行针对特应性皮炎(AD)的临床II期试验,已在今年8月完成临床II期首例患者给药,有望成为该适应症first-in-class的TSLP抗体药物。合作伙伴正大天晴正在中国开展针对严重哮喘以及慢性鼻窦炎伴鼻息肉的临床II期试验,进度也在国内目前最为靠前。
据悉,Bosakitug在临床前研究中显示出比阿斯利康/安进的Tezepelumab具有更高的亲和力,多个体外生物活性测评方法中展示出较Tezepelumab更高(几倍到150倍以上)的药效活性,并在多种动物模型中可剂量依赖地抑制疾病相关指标。同时,由于特应性皮炎等自身免疫性疾病多发于儿童和青少年时期,药物的长期疗效与安全性就显得尤为重要。根据博奥信近日投资者日披露,Bosakitug优异的安全性数据完全能够支持儿童和青少年相关适应症开发,并且其较长的半衰期具有大幅度延长给药周期的潜力。
在Bosakitug的临床开发方面,博奥信也是采取了差异化的策略。在此前Dupixent(度普利尤单抗)的3期临床试验中,只有不到50%的特应性皮炎患者症状得到有效缓解。博奥信与美国顶级的特应性皮炎领域的临床专家,乔治华盛顿大学医学与健康科学学院皮肤病学教授Jonathan Silverberg博士共同探索创新的TSLP联用方案,在此次临床II期研究旨在评估BSI-045B(Bosakitug)作为单一疗法以及与Dupixent(度普利尤单抗)联用的疗效,以期进一步提高针对特应性皮炎患者的治疗效果。
在大部分公司都在跟随首款上市的TSLP单抗布局哮喘等呼吸科适应症的情况下,博奥信另辟蹊径,将特应性皮炎作为Bosakitug主要开发的适应症之一并处于领先地位,不仅是基于对中重度特应性皮炎未满足的治疗需求的理解,而且还有望凭借差异化的适应症布局快速获得市场份额。同时,该分子产品生命周期广阔,亦可支持其他适应症的开发,从而进一步扩大市场。
康诺亚CM326
除了博奥信/正大天晴的Bosakitug之外,康诺亚生物的TSLP单抗CM326在国内也开展了治疗特应性皮炎的临床研究。2022年8月,康诺亚生物开展并公示了CM326注射液的II期临床试验(登记号:CTR20222170),适应症为中重度特应性皮炎(已于2023年6月完成患者入组)。该公司是继正大天晴之后,第二家TSLP单抗在国内进入II期临床试验的企业。
针对其他适应症,康诺亚在2023年2月完成了CM326治疗慢性鼻窦炎伴鼻息肉的Ib/IIa期临床试验的患者入组。2021年11月,康诺亚授予石药集团CM326的独家许可,在中国(不包括香港、澳门及台湾地区)进行该产品于中重度哮喘和慢性阻塞性肺病(COPD)等呼吸系统疾病开发与商业化,并成为上市许可持有人。石药集团已就中重度哮喘治疗开展II期临床研究,目前正在进行患者入组。
荃信生物QX008N
除此之外,荃信生物的TSLP单抗QX008N已于2022年5月在中国获得临床试验默示许可,拟开发用于治疗哮喘和慢性阻塞性肺疾病。2022年8月,QX008N获得美国FDA的临床试验许可,适应症为重度哮喘,成为荃信生物首个获得FDA临床试验许可的产品。
和铂医药/科伦博泰:SKB378/HBM9378
和铂医药/科伦博泰共同开发的新一代抗TSLP全人源单克隆抗体SKB378/HBM9378于2021年12月获得NMPA批准针对中重度哮喘患者的临床试验申请,2022年9月,科伦博泰宣布该药在中国完成I期临床试验首例受试者给药。
智翔金泰GR2002
2023年4月,智翔金泰自主研发的抗TSLP双抗GR2002注射液获批临床,用于治疗哮喘,成为全球首个获批临床的TSLP双表位双抗。
结语
TSLP在1994年被首次发现,在近30年的时间里,多家药企曾在TSLP靶点上碰壁,但依然为业界留下了宝贵的经验。目前虽然全球仅有一款TSLP靶向药物获得批准,不过随着机制与疾病的研究越来越明晰,相信这一赛道会有越来越多的成果涌现。在自免疾病领域,存在着庞大的患者群体和未满足治疗需求,无论是国内还是国际市场,围绕TSLP靶点的药物开发依然大有可为。
参考:
NMPA/CDE;
FDA/EMA/PMDA;
相关公司公开披露;
Ziegler, Steven F. “The role of thymic stromal lymphopoietin (TSLP) in allergic disorders.” Current opinion in immunology vol. 22,6 (2010): 795-9. doi:10.1016/j.coi.2010.10.020;
张珍珍,李萍,严星强.儿童特应性皮炎的流行病学研究现状[J].国际流行病学传染病学杂志, 2020, 47(2):4.DOI:10.3760/cma.j.cn331340-20190928-00169.;
王思航,左亚刚.胸腺基质淋巴细胞生成素在特应性皮炎的作用机制及临床应用[J].中华临床免疫和变态反应杂志,2022,16(1):66-71.DOI:10.3969/j.issn.1673-8705.2022.01.013.;
https://cn.biosion.com/news/datail/64c7ba25fbf08f3fb51dc654;等等
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论