
11月8日,Lilly公司表示,美国食品和药物管理局(FDA)批准了该公司的Zepbound™(tirzepatide,替尔泊肽)注射液,这标志着Lilly的tirzepatide正式进入慢性体重管理市场。这是首款也是唯一一款葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂的肥胖症治疗药物。
药物基本信息

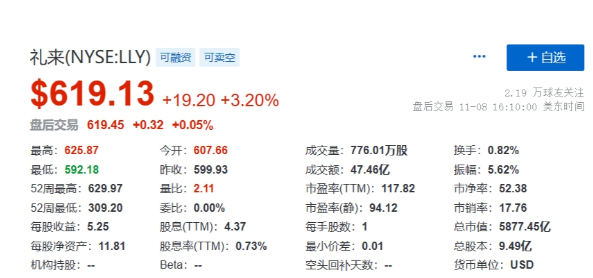
截图来源:药融云全球药物研发数据库
该药将于今年年底在美国上市,共有六种剂量,一个月的供应价格约为1060美元。据Lilly公司称,这一价格比诺和诺德公司用于减肥的GLP-1药物Wegovy 2.4mg剂量的上市价格低约20%。根据诺和诺德公司网站的资料,Wegovy 的上市价格为每包1,349.02美元。

首次消息影响,礼来股价上涨3.2%,市值达到5877.45亿美元,即将突破6000亿美元。此外礼来在第三季度财报中显示替尔泊肽前三季度销售收入总计29.6亿美元,大增1354%,Q3销售额达到14.1亿美元,环比增加约44%,快速放量。
Zepbound 适用于患有肥胖症(体重指数大于或等于30 kg/m2)或超重(体重指数大于或等于27 kg/m2)并同时患有高血压、血脂异常、2 型糖尿病、阻塞性睡眠呼吸暂停或心血管疾病等与体重有关的疾病的成人,以减轻体重并保持体重。使用时应减少热量饮食并增加体育锻炼。Zepbound不得与其他含有替泽帕肽的产品或任何GLP-1受体激动剂药物同时使用,也未在有胰腺炎病史或患有严重胃肠道疾病(包括严重胃瘫)的患者中进行过研究。
此次批准是基于3期SURMOUNT-1和SURMOUNT-2试验的结果。SURMOUNT-1是一项对2539名患有肥胖症或体重超标以及与体重相关的疾病(不包括糖尿病)的成年人进行的研究,与安慰剂相比,服用Zepbound作为节食和运动的辅助药物72周后体重大幅下降,患者的体重比开始时平均减轻了15.7%。此外,根据未控制1型错误的数据,在Zepbound的最高剂量下,三分之一的患者能够减轻超过58磅(约52.6斤),相当于体重减轻25%,而此数值在安慰剂组患者中仅为1.5%。这项研究中受试者的平均初始体重为231磅(209.6斤)。
Lilly公司首席执行官Dave Ricks表示:“拥有商业保险的患者每月可支付低至25美元的费用,而没有商业保险的患者的价格可能低至5折。”Lilly糖尿病与肥胖症总裁Mike Mason表示:“定价决定是为了改善抗肥胖症药物的可及性。”
除了礼来的SURMOUNT计划,这家大制药公司还计划开展一项III期研究,调查肥胖或超重青少年皮下注射替尔泊肽与安慰剂的对比情况。该研究将持续约90周,计划招募约150 名患者参加随机双盲试验。
参考资料:
1.公司官网
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)










 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论