
2023年10月3日——基石药业(香港联交所代码:2616),一家专注于研究开发及商业化创新肿瘤免疫疗法及精准治疗药物的领先生物制药公司,今日宣布,择捷美®(舒格利单抗注射液)联合化疗一线治疗局部晚期或转移性胃/胃食管结合部腺癌的III期研究(GEMSTONE-303)已入选2023年欧洲肿瘤内科学会(ESMO)年会重磅摘要(late-breaking abstract, LBA),并将以口头报告形式公布详细数据。
⦁ 研究领域:上消化道肿瘤
⦁ 日期:2023年10月21日下午17:20-17:25(欧洲中部夏令时间)
⦁ 报告形式:口头汇报
⦁ 题目:GEMSTONE-303: prespecified progression-free survival (PFS) and overall survival (OS) final analyses of a phase 3 study of sugemalimab plus chemotherapy vs placebo plus chemotherapy in treatment-naïve advanced gastric or gastroesophageal junction (G/GEJ) adenocarcinoma
⦁ 报告编号:LBA79
⦁ 主要研究者:沈琳 教授
⦁ 报告人:张小田 教授
GEMSTONE-303是一项多中心、随机、安慰剂对照的III期注册性临床试验,旨在评估择捷美®联合CAPOX化疗方案(奥沙利铂+卡培他滨)作为一线治疗无法手术切除的 PD-L1表达≥5%的局部晚期或转移性胃腺癌或胃食管结合部腺癌的疗效和安全性。此前,该研究已达到预设的双主要终点——研究者评估的无进展生存期(PFS)和总生存期(OS),以及关键次要研究终点,包括盲态独立中心审阅委员会(BICR)评估的PFS,和研究者评估的客观缓解率(ORR)及缓解持续时间(DoR)等。
研究结果显示,择捷美®联合化疗相较于安慰剂联合化疗,能显著延长患者PFS和OS,且差异具有统计学显著性与临床意义;安全性与既往报道的择捷美®相关临床研究结果一致,未发现新的安全性信号。
目前,中国国家药品监督管理局(NMPA)正在审评择捷美®联合化疗一线治疗晚期胃癌的新适应症上市申请,择捷美®有望成为全球首个在胃/胃食管结合部腺癌适应症获批的PD-L1单抗。
关于择捷美®(舒格利单抗注射液)
择捷美®是由基石药业开发的抗PD-L1单克隆抗体,择捷美®的开发是基于美国Ligand公司授权引进的OmniRat®转基因动物平台。该平台可一站式产生全人源抗体。作为一种全人源全长抗PD-L1单克隆抗体,择捷美®是一种最接近人体的天然G型免疫球蛋白4(IgG4)单抗药物。择捷美®在患者体内产生免疫原性及相关毒性的风险更低,这使得择捷美®与同类药物相比具有独特优势。
舒格利单抗基本信息
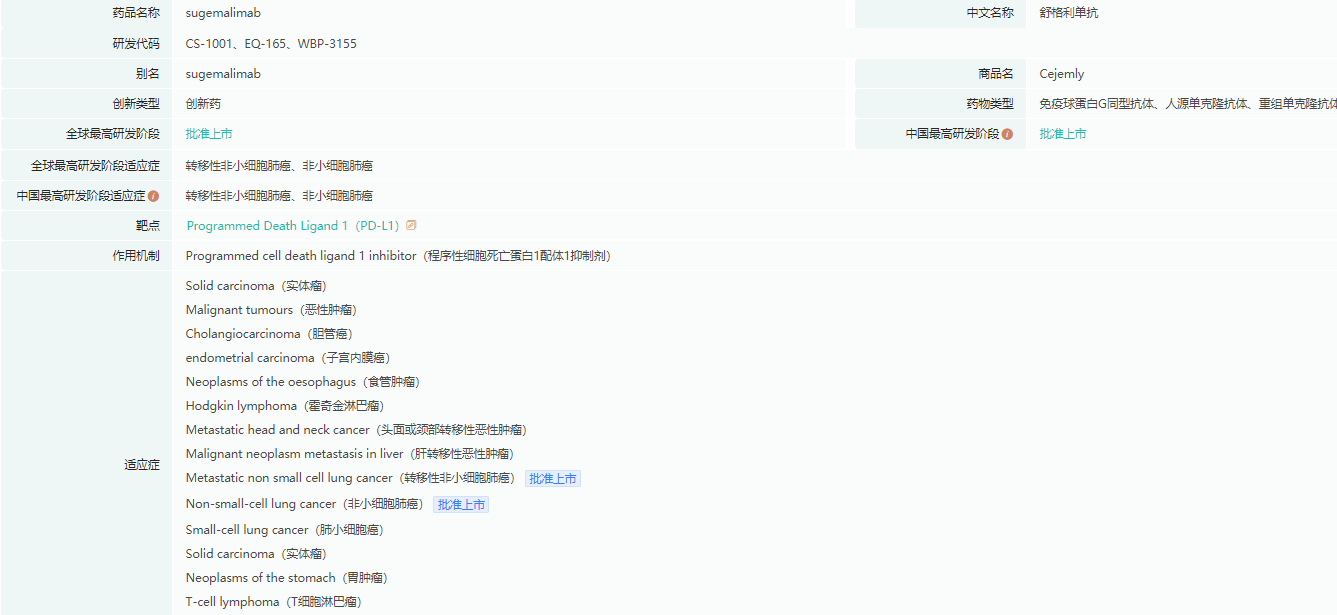
截图来源:药融云全球药物研发数据库
目前,NMPA已批准择捷美®两项适应症,用于治疗同步或序贯放化疗后未出现疾病进展的、不可切除、III期非小细胞肺癌(NSCLC)患者以及联合化疗一线治疗转移性鳞状和非鳞状NSCLC患者。
择捷美®用于治疗复发难治性结外NK/T细胞淋巴瘤(R/R ENKTL)、联合化疗一线治疗无法手术切除的局部晚期或转移性胃/胃食管结合部腺癌、联合化疗一线治疗无法手术切除的局部晚期,复发或转移性食管鳞癌的适应症上市许可申请已获NMPA受理,目前正在审评中。
此外,欧洲药品管理局(EMA)和英国药品和医疗保健用品管理局(MHRA)均已受理舒格利单抗用于一线治疗转移性NSCLC的上市许可申请,两项申请目前正在审评中。
参考资料:
1.公司官网
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)










 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论