
近日,药融云数据库显示,绿竹生物的重组带状疱疹疫苗(CHO 细胞)(LZ901)启动了首项III期临床试验,用于预防水痘-带状疱疹病毒(Varicella-Zoster Virus,VZV)感染引起的带状疱疹(Herpes Zoster,HZ)及并发症。据此前绿竹生物公告,公司预计在2024年下半年向国家药监局提交LZ901的生物制品许可申请(BLA),预计2025年实现商业化。
本次试验目标入组人数26000,评价在40岁及以上人群中接种重组带状疱疹疫苗(CHO细胞)保护效力、安全性。主要终点为保护效力(根据全程免疫30天后的HZ有效终点病例数与安慰剂相比计算疫苗的保护效力)和批间一致性(3个不同批次试验组的抗gE抗体几何平均含量(GMC)比值)。

截图来源:药融云中国临床试验数据库
LZ901是绿竹生物的核心在研产品,用创新抗原设计,诱导高水平体液及细胞免疫应答的同时,兼具较好的安全性,有望成为全球首款具有四聚体分子结构的带状疱疹疫苗,用于预防年龄为50岁及以上成人水痘带状疱疹病毒引起的带状疱疹。
LZ901抗原四聚体和作用原理
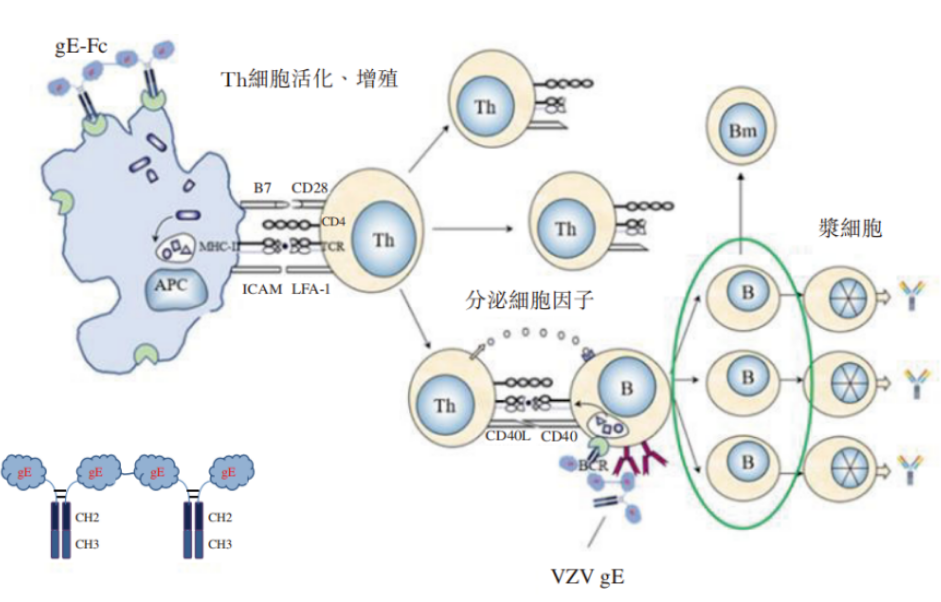
图片来源:绿竹生物公司招股书
今年5月底,绿竹生物宣布,LZ901已完成中国II期临床试验,相关数据如下。这使LZ901成为目前国内在研的重组蛋白带状疱疹疫苗中,最早完成II期临床试验的产品,也将为绿竹生物的商业化提速。
- 免疫原性研究方面,LZ901高剂量试验组的抗体几何平均浓度(“GMC”)、几何平均滴度(“GMT”)和阳转率均显著高于低剂量试验组。另一方面,LZ901高、低剂量试验组抗体GMC、GMT和阳转率均显著高于安慰剂试验组;
- 安全性研究方面,试验中的不良事件(“AE”)主要发生在0-7天内,试验疫苗发生的1级、2级和3级AE发生率分别约为23.74%、6.02%和1.00%。于中国进行LZ901的II期临床试验期间,并无观察到4级AE及严重AE;
- II期临床试验数据为LZ901的III期临床试验提供了确切依据。III期临床试验剂量确定为100微克╱0.5mL╱瓶,及免疫程序应包括两剂,且第二剂在第一剂接种后30天给药。
剑指Shingrix,LZ901在国产重组带状疱疹管线中进度领先
近年来带状疱疹的发病率呈缓慢上升趋势,随着人口寿命延长,预计带状疱疹后神经痛(PHN)的总患病率将会上升,接种疫苗是最有效可行的预防手段。
根据弗若斯特沙利文资料,按销售收入计,中国带状疱疹疫苗市场从2015年的零增加至2025年的人民币108亿元,预计2021年至2025年的复合年增长率为103.8%,到2030年将达到人民币281亿元的市场空间。总体来看带状疱疹疫苗空间广阔。
目前全球仅四款带状疱疹疫苗上市,分别为默沙东的Zostavax、GSK的Shingrix(已在国内上市)、SK集团的SkyZoster及百克生物的感维(已在国内上市)。其中,Shingrix2022年销售额达到36亿美元,同比增长72%,几乎占据了带状疱疹疫苗市场100% 的份额。百克生物的感维于今年1月正式获批,将在6月正式上市销售。
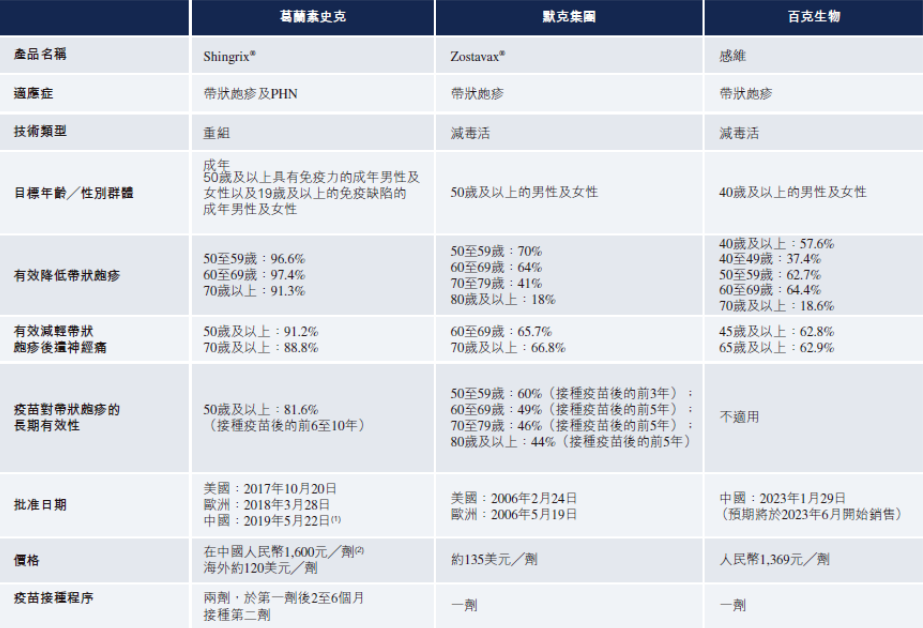
图片来源:绿竹生物公司招股书
据药融云数据库,除了绿竹生物,国内还有瑞科生物、嘉晨西海、沃森/艾博、辉瑞/BioNTech、Moderna等药企的带状疱疹疫苗均在研发推进中。其中上海生物制品研究所、中慧元通/上海怡道、迈科康生物等药企进度较快,分别为减毒活疫苗(II期)、重组疫苗(I/II期)和重组疫苗(I期)。
9月25日,CDE官网显示,华诺泰的重组带状疱疹疫苗获批临床(默示许可),同意开展预防带状疱疹的Ⅰ、Ⅱ期临床试验。
目前来看,绿竹生物的LZ901进度最快。尽管LZ901和Shingrix一样也是采用重组蛋白技术,但机制有所不同,Shingrix采用创新的佐剂技术,而LZ901具有创新的四聚体分子结构。
此前绿竹生物也公布了LZ901与Shingrix的头对头临床试验数据。结果显示,LZ901的安全性、细胞免疫、预防有效性的表现都具有相较Shingrix的显著优势,在体液免疫方面也达到和Shingrix相当的水准。
价格方面,绿竹生物曾在招股书中表示,LZ901预计定价500-800元,需接种两针,相比Shingrix(定价1598元,需接种两针)和感维(定价约1369元,只需接种一针)均有明显价格优势。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论