
9月4日,中国国家药监局药品审评中心(CDE)官网公示,德昇济医药申请的1类新药D3L-001获得临床试验默示许可,拟开发用于HER2阳性晚期实体瘤。公开资料显示,这是一款靶向HER2和CD47的双特异性抗体,此前已在美国获批临床。

来源:CDE官网
CD47/SIRPα是近年来肿瘤免疫领域中的重要信号通路之一。通过抗体阻断CD47与其配体SIRPα结合,可解除巨噬细胞免疫抑制,激活其抗肿瘤作用。
据德昇济医药早前新闻稿介绍,D3L-001能够通过HER2的高亲和活性优先与肿瘤细胞结合,降低其与正常组织的结合,从而减少CD47靶点潜在的血液毒性,并能使抗体依赖的细胞毒性作用(ADCC)和抗体依赖的细胞吞噬作用(ADCP)协同作用发挥到最大程度。
在2023年美国癌症研究协会(AACR)年会上,德昇济医药展示了D3L-001的临床前研究数据。据该公司早前新闻稿介绍,D3L-001与已经处于临床研究阶段的D3S-001以及该公司后续研发管线产品之间存在协同和联合的潜力。

德昇济医药成立于2020年,致力于以临床价值为导向,开发肿瘤及免疫精准治疗药物。目前已建立包括6款自主研发的候选新药产品管线,涵盖小分子以及抗体/双抗领域。其中小分子药物涉及:D3S-001、D3S-002、D3S-003。大分子涉及:实体瘤的靶向HER2和CD47的双抗D3L-001、D3L-002、D3L-003。
研发管线
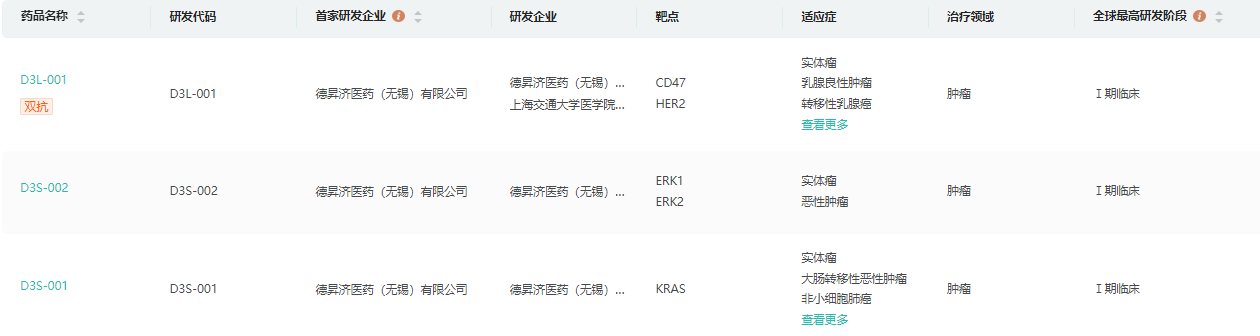
数据来源:药融云全球药物研发数据库
参考资料:
1.公司官网
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论