
8月30日,Outlook Therapeutics (OTLK.O)表示,已收到美国食品和药物管理局(FDA)对该公司的眼病单抗药物ONS-5010 BLA 的完整回复函(CRL)。
虽然 FDA 承认 NORSE TWO 关键试验达到了其安全性和有效性目标,但由于在批准前检查期间发现了几处CMC问题,FDA拒绝批准ONS-5010。
早在2022年5月,ONS-5010 的上市就曾FDA延期,如今又再遭延期。
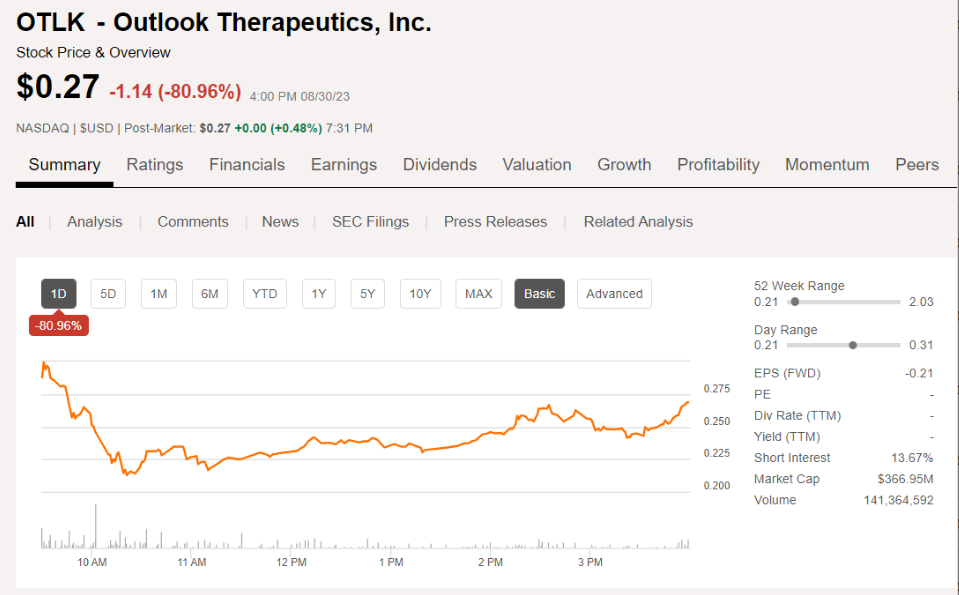
受此影响,Outlook Therapeutics股价大跌80%,目前市值为3.67亿美元。
关于ONS-5010
湿性年龄相关性黄斑变性(湿性AMD)是一种慢性眼部疾病,会导致患者视力模糊或视野盲点,是老年人失明的主要原因。
ONS-5010(Lytenava)是一款在研贝伐珠单抗眼用制剂,用于治疗湿性AMD和其他视网膜疾病,通过玻璃体内注射给药,从而减少内皮细胞增殖、血管渗漏和视网膜新血管形成达到治疗作用。
ONS-5010基本信息

数据来源:药融云全球药物研发数据库
Outlook Therapeutics向 FDA 提交的申请基于一项后期试验,该试验表明,在测试区分形状和细节的能力时,该药物改善了 41.7% 患者的视力,这些患者能够阅读至少 3 行或 15 个字母。
据了解,由于目前没有批准的贝伐珠单抗眼用制剂,临床上治疗视网膜患者使用的是由配药房提供的未经批准的重新包装的贝伐珠单抗注射剂,存在被污染风险并且其效价和疗效可能不一致。如果ONS-5010获批,有望取代药房的贝伐珠单抗,从而满足治疗湿性AMD的需要。
Outlook Therapeutics 将尽快与 FDA 召开会议来解决这些问题。欧洲药品管理局将开始对该药物的审查程序,预计明年初做出决定。
关于Outlook Therapeutics
Outlook Therapeutics, Inc.于2010年1月5日在新泽西州注册成立。该公司是一家临床晚期生物制药公司,致力于开发首个经美国FDA批准用于视网膜适应症的贝伐单抗眼科制剂。他们直接或通过战略合作伙伴推出贝伐单抗,作为美国、英国、欧洲、日本等市场首个也是唯一批准的贝伐单抗,用于治疗湿性老年性黄斑变性、湿性AMD、糖尿病性黄斑水肿(DME)和视网膜分支静脉阻塞。
参考资料:
1.公司官网
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论