
此次申请是基于INSPIRE与COMMAND两项支持risankizumab作为诱导和维持治疗的3期临床试验数据,分析显示试验达到临床缓解主要终点(根据自适应Mayo评分)和关键次要终点。

Risankizumab是一种人源化、IgG1亚型的单克隆抗体,可以借由与IL-23的p19亚基结合而选择性地拮抗IL-23。IL-23是一种与炎症有关的细胞因子,被认为与许多慢性免疫疾病有关。目前,Skyrizi已获得3项FDA批准的适应症,包括克罗恩病、中重度斑块状银屑病,以及成人活跃银屑病关节炎。
Risankizumab基本信息
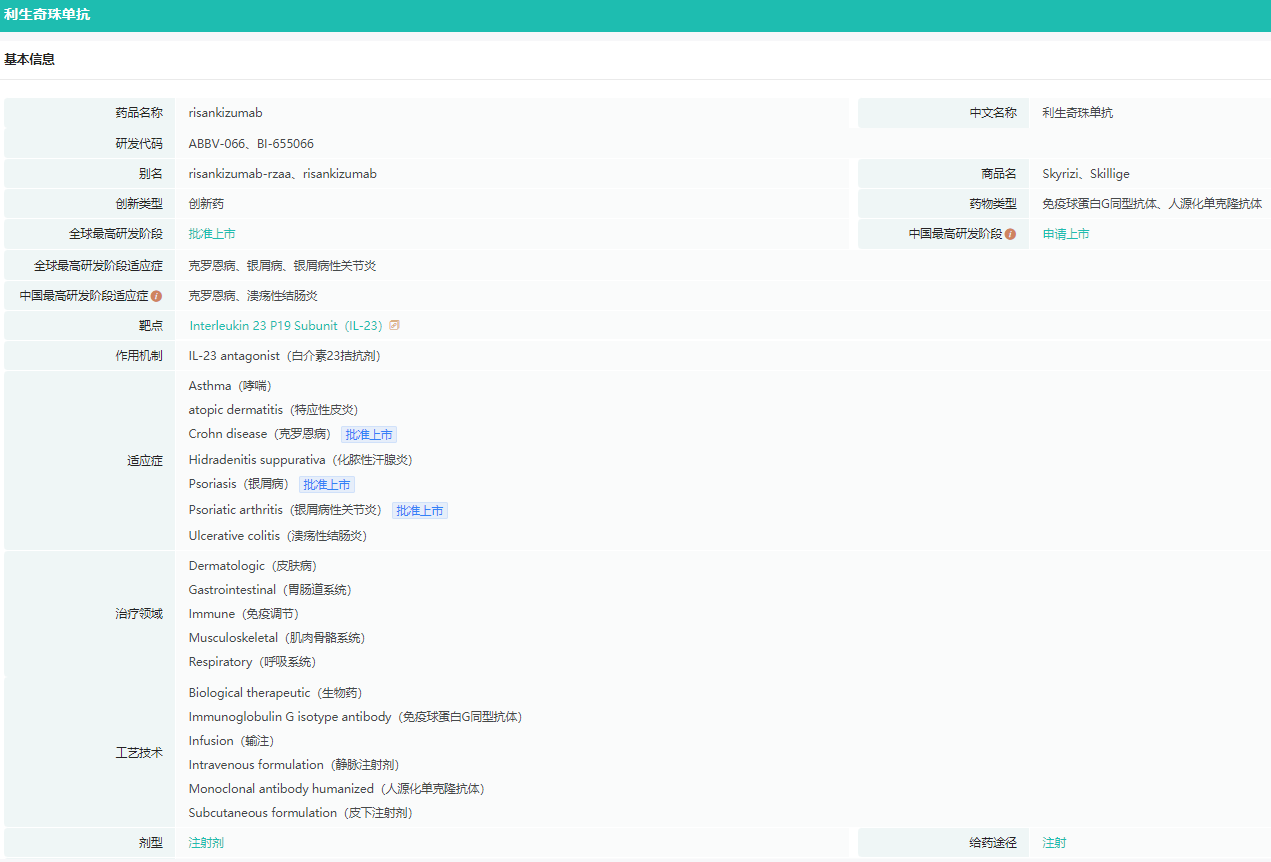
截图来源:药融云全球药物研发数据库
据实验数据显示,接受180 mg、360 mg risankizumab治疗的患者中,有显著更高比例在52周时达到临床缓解:分别为40%和38%,此数值在对照组中为25%(p<0.01)。接受180 mg与360 mg risankizumab治疗的患者中,分别有51%与48%达到内镜检查改善,而仅有32%对照组患者产生改善(p<0.001)。
此外,接受180 mg与360 mg risankizumab治疗的患者中,分别有43%和42%的患者达到组织学内镜检查粘膜改善,显著高于对照组患者(23%,p<0.001)。此外,接受180 mg与360 mg risankizumab治疗的患者中,亦有显著更高的比例在52周时达到无皮质类固醇的临床缓解(p<0.01)。
参考资料:
1.公司官网
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)









 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论