
7月24日,罗氏(Roche)宣布,将通过Alnylam的RNAi平台收购一款处于中期阶段的治疗高血压的RNAi候选药物zilebesiran。
zilebesiran药物研发信息
 图片来源:药融云全球药物研发数据库
图片来源:药融云全球药物研发数据库根据协议条款,Alnylam将获得3.1亿美元的预付款,并有资格获得开发、监管和商业里程碑,包括重大近期里程碑,以及在美国的同等损益份额和美国以外的特许权使用费,总额可能达到28亿美元。
Alnylam药物研发管线查询
 图片来源:药融云全球药物研发数据库
图片来源:药融云全球药物研发数据库两家公司将共同开发和共同商业化zilebesiran并平分在美国的利润和亏损,而罗氏将负责美国以外的销售,并向Alnylam支付这些地区的专利费。在罗氏的参与下,Alnylam将牵头首个适应症的联合临床开发计划,其中包括在zilebesiran提交监管机构批准之前的心血管预后试验,所有开发成本由Alnylam和罗氏共同承担(罗氏承担60%)。
罗氏制药首席执行官Teresa Graham表示,我们很高兴与Alnylam合作,与Alnylam这样的强大合作伙伴一起,我们期待着为高血压高危患者和潜在的其他心血管适应症患者带来重大影响。
Alnylam首席执行官Yvonne Greenstreet MBChB表示,通过这次合作,我们可以以更稳健的方式开发zilebesiran,使我们能够在启动时掌握心血管结果数据,以确保结果不仅与卫生当局相关,而且与可及性和临床实践相关,以便最终覆盖尽可能多的患者。
关于zilebesiran
在一项1期研究中,与安慰剂相比,zilebesiran与血清血管紧张素原(AGT)的剂量依赖性降低相关,实现了强直性血压控制,并在≥200 mg单次给药后持续6个月,在24小时期间持续持久地降低血压。Zilebesiran也显示出可接受的安全性,支持继续进行临床开发。Alnylam的KARDIA 2期临床项目正在研究zilebesiran的安全性和疗效,可以作为单药治疗(KARDIA-1),也可以与三种标准抗高血压药之一联合治疗(KARDIA-2) 。

关于Alnylam
Alnylam自1990年进入核酸药物领域以来,目前有5款RNAi药物获批上市,包揽了获批上市siRNA药物的全部名额。包括安进、阿斯利康等在内的其他公司,也通过收购、合作开发等方式加入了这个赛道竞争。
公司研发管线
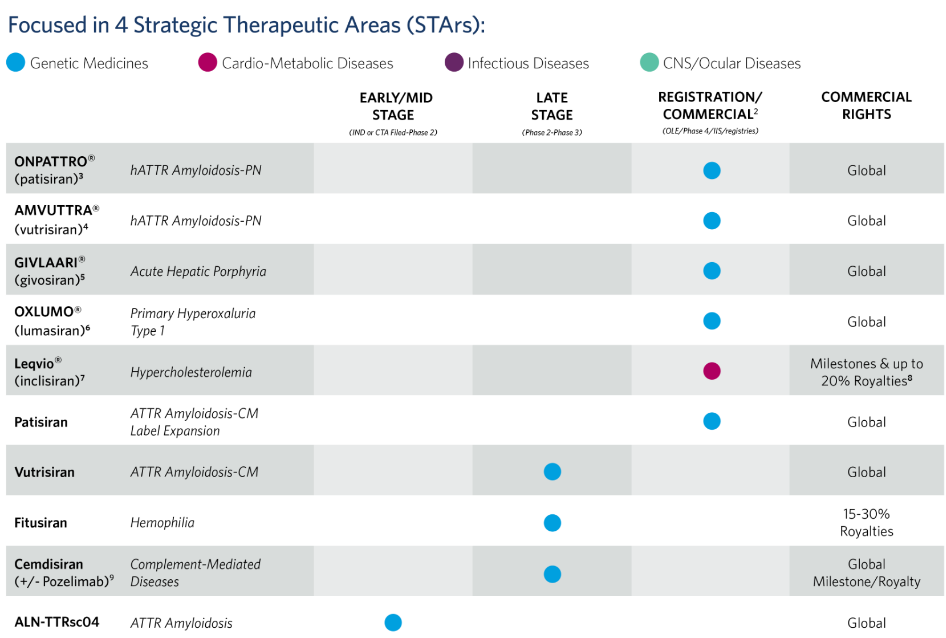

2018年,FDA批准了首款RNAi疗法,即Alnylam开发用于治疗遗传性转甲状腺素蛋白淀粉样变性(hATTR)患者的siRNA药物Onpattro(Patisiran)。
第二款RNAi药物Givlaari(givosiran),用于治疗急性肝卟啉症的成年患者。
第三款由Alnylam和诺华合作开发,是用于治疗成人原发性高胆固醇血症(杂合子家族性和非家族性)或混合型血脂异常的RNAi药物Leqvio(inclisiran)。
第四款是Amvuttra(vutrisiran)。2022年6月,经FDA获批上市,用于治疗遗传性转甲状腺素蛋白介导(hATTR)淀粉样变性成人患者的1、2期多发性神经 病。该药物是首个也是唯一FDA批准的能逆转神经损伤的、长效的RNAi治疗药物。
参考来源:
[1] 罗氏(Roche)、Alnylam公司官网
[2] 药融云数据库
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论