近期,武田2023年财报发布,财报显示,公司2022财年全年营收40275亿日元(约合298.33亿美元,财报里公布的固定汇率),同比增长12.8%。研发投入6333亿日元(46.91亿美元),占总营收的15.72%,净利润3170亿日元(23.48亿美元)。
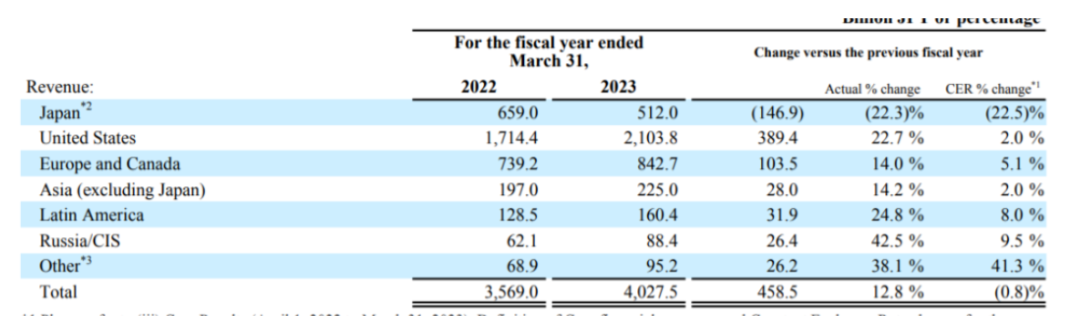
来源:武田2023年财报
据武田2023年财报,公司收入主要来源于5大板块:消化道产品管线、罕见病治疗管线、血浆制品管线、精神疾病治疗领域和抗肿瘤管线。其中,消化道产品管线是最主要来源,全年收入10945亿日元,同比增长25%,Entyvio(维多珠单抗)是武田在该治疗管线的顶梁柱,单品销售额达7027亿日元(52.05亿美元),同比增长34.7%。
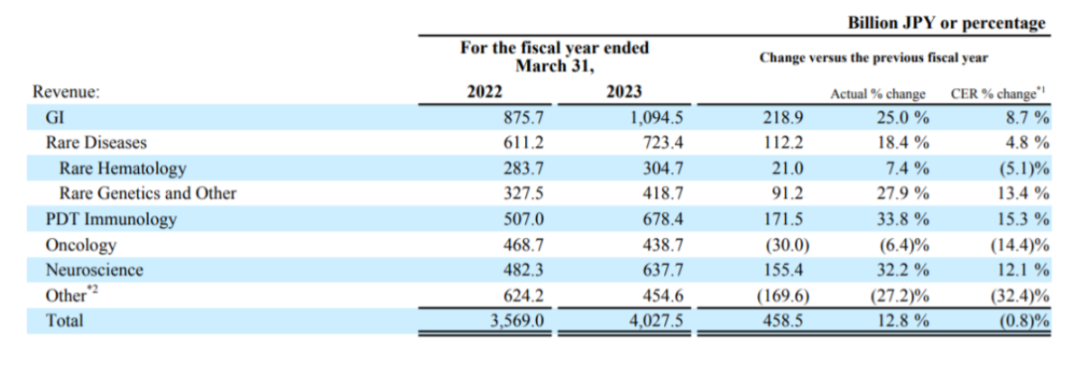
来源:武田2023年财报
在武田2023年财报发布后,公司还宣布了6个研发项目的削减计划。
1.TAK-954
武田将放弃II期临床试验失败的术后胃肠功能障碍候选药物TAK-954。据药融云数据库显示,这是一款选择性5-HT4受体激动剂,从爱尔兰公司Theravance Biopharma授权引进,由此也结束了两家公司之间的合作。
截图来源:药融云全球医药交易数据库
2.TAK-018(sibofimloc)
sibofimloc是一款与法国Enterome Biosciences公司合作开发的FimH粘附抑制剂,用于克罗恩病(CD)。此款药物终止研发的原因是因为未能招募到足够的患者进行II期试验。
3.Ninlaro(ixazomib)
Ninlaro是FDA批准的首个口服蛋白酶体抑制剂,用于治疗复发性或难治性多发性骨髓瘤(R/R MM)。根据研究的最终分析,武田决定停止在美国和欧洲开发新的适应症——治疗首次发作的多发性骨髓瘤,而无需造血干细胞移植。
Ninlaro上市时间轴(重要国家,完整内容请登录“药融云数据库www.pharnexcloud.com/?mh”查看)
截图来源:药融云全球药物研发数据库
4.LIVTENCITY(马里巴韦)
在与监管当局审查了试验结果后,武田停止了该药物在造血干细胞移植后巨细胞病毒感染的一线治疗适应症的开发。
5.Taxilo
该药物在缓激肽介导的血管性水肿研究中未能达到其主要终点。
6.Zejura(niraparib)
武田停止Zejura在乳腺癌研究中的患者招募。Zejura是一款PARP抑制剂,目前用于卵巢癌。

此前,武田已经放弃AAV基因治疗管线,一方面是因为公司着重于开发非病毒载体,另一方面是因为公司开发AAV的适应症已经被人捷足先登了。这使得AAV即使开发出来,也不一定能够独占市场。
同时,武田虽然暂停了AAV基因疗法研发项目,但他们也在探索外部合作来努力维护从事AAV基因治疗项目的研发人员。例如:武田分别与Poseida和Code Biotherapeutics的签署了数十亿美元基因疗法合作协议。
但受砍管线的影响,公司也决定在列克星敦,剑桥,北瑞汀三个城市的四个工作地点裁员总计186人(138+42+5+1)。所有的裁员将于7月初开始,2024年3月31日前结束。
参考资料:
[1] 药融云数据库
[2] 武田2023年财报
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论