
2023年1月29日,国家药监局发布通知,附条件批准海南先声药业有限公司申报的1类创新药先诺特韦片/利托那韦片组合包装(商品名称:先诺欣)、上海旺实生物医药科技有限公司申报的1类创新药氢溴酸氘瑞米德韦片(商品名称:民得维)上市。
两款药物均为国产的口服小分子新冠病毒感染治疗药物,用于治疗轻中度新型冠状病毒感染(COVID-19)的成年患者。患者应在医师指导下严格按说明书用药。国家药监局要求上市许可持有人继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果。
(图源:NMPA官网)
其中,据先声药业官网,推荐剂量为先诺特韦0.750g(0.375gx2片)联用利托那韦0.1g(0.1gx1片),每12小时一次口服给药,连续服用5天。另外,先诺欣®抗新冠病毒效果显著:先诺欣®组病毒载量呈现快速、大幅的下降;用药后第5天,病毒载量对比安慰剂最大下降超96%。作为首款获批的国产3CL蛋白酶抑制剂,先诺欣®的成功上市,有望为中国患者带来更有效的治疗选择。
首个上市的国产3CL蛋白酶抑制剂——先诺欣®

先诺欣®(先诺特韦片/利托那韦片组合包装)是一款3CL蛋白酶抑制剂,其作用机制与辉瑞已上市的Paxlovid相同。其中先诺特韦针对SARS-CoV-2病毒复制必须的3CL蛋白酶,与低剂量利托那韦联用有助于减缓先诺特韦在体内的代谢或分解,提高抗病毒效果。先诺欣®是先声药业集团有限公司(2096.HK,以下简称“先声药业”)与中国科学院上海药物研究所、武汉病毒研究所联合开发的口服小分子抗新冠病毒创新药。
据药融云数据库显示,先声药递交的的先诺特韦片/利托那韦片组合包装(先诺欣®)新药上市申请(NDA)于2023年1月16日获国家药品监督管理局(NMPA)以药品特别审批程序受理,拟用于治疗轻至中度新型冠状病毒感染(COVID-19)成年患者。
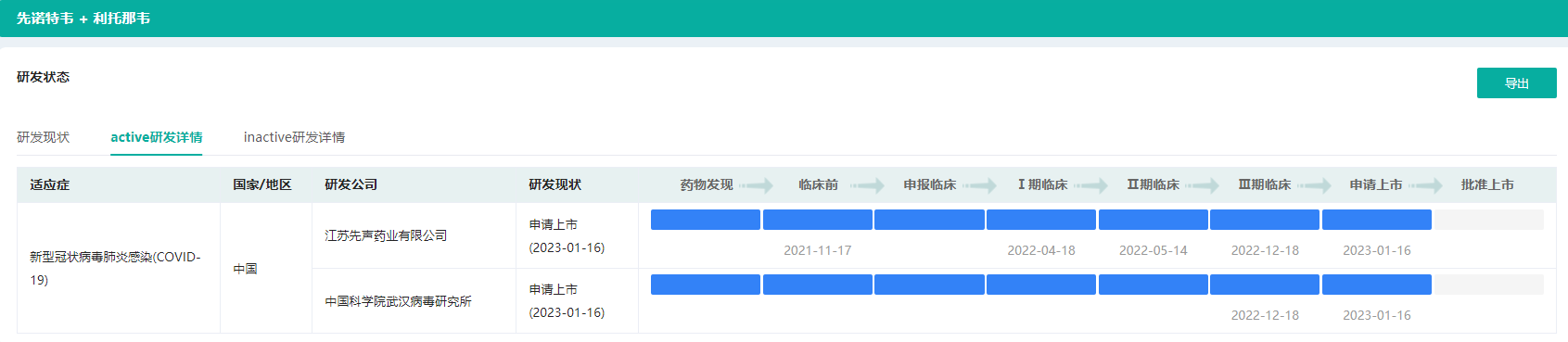
截图来源:药融云全球药物研发数据库
3CL蛋白酶是在冠状病毒中发现的主要蛋白酶,在病毒复制过程不可或缺,3CL切割位点高度保守,不易受病毒突变影响,具有广谱抗冠状病毒活性。在人体宿主内没有3CL同源蛋白,选择性、特异性较高,副作用风险较小。先诺欣®临床前研究未发现遗传学毒性,且多项临床研究证实其安全性良好。
研究结果证实,先诺欣®对中国轻至中度COVID-19成年患者安全有效,有显著的临床疗效。
- 加快症状恢复,缩短病程:在1208例有症状的轻中度COVID-19成年患者中,相较安慰剂,先诺欣®显著缩短11种目标COVID-19症状首次达到持续恢复时间约1.5天,其中重症高风险亚组人群显著缩短约2.4天,同时临床数据提示尽早使用先诺欣®疗效更优。
- 显著的抗病毒效果:先诺欣®组病毒载量呈现快速、大幅的下降;用药后第5天,病毒载量对比安慰剂最大下降超96%。
- 核酸转阴时间缩短:先诺欣®组核酸转阴时间较安慰剂组缩短约2.2天。
在国产3CL蛋白酶抑制剂研发中,先声药业的SIM-0417一直处于第一梯队,是国产3CL蛋白酶抑制剂首个报上市、也是首个获批上市的。另外,众生药业的RAY -1216、广生堂的GST-HG171也紧跟其后,目前都处于临床三期试验阶段。(《新冠"克星"!3CL蛋白酶抑制剂研发,先声药业国内首个报上市》)。
全球3CL蛋白酶抑制剂研发现状(部分)

截图来源:药融云全球药物研发数据库
参考来源:
[1] NMPA官网
[2] 先声药业官网
[2] 药融云数据库
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论