
中国上海2023年1月31日,原启生物,一家致力于肿瘤免疫治疗细胞产品处于临床阶段的创新药企,今日宣布公司自主的靶向GPRC5D的CAR-T细胞产品OriCAR-017治疗复发难治多发性骨髓瘤(RRMM)的临床研究数据在《Lancet Haematology》上发表(2022年影响因子:30.153)题为“GPRC5D CAR T cells (OriCAR-017) in patients with relapsed or refractory multiple myeloma (POLARIS): a single-centre, single-arm phase 1 trial”。
POLARIS研究是OriCAR-017的首次人体研究,旨在探索单次静脉输注OriCAR-017在复发难治多发性骨髓瘤患者的安全性,耐受性和初步的抗肿瘤作用(NCT05016778)。到截止日期(2022年6月30日)结果显示,在10例复发难治多发性骨髓瘤患者中,POLARIS研究显示了OriCAR-017在治疗复发难治多发性骨髓瘤患者令人兴奋的临床获益:
- 中位随访时间238天 (范围:99,345天)
- 安全性:无剂量限制性毒性(DLT),无严重不良事件(SAE)和死亡病例报道,常见≥3级的不良反应主要是血液系统的毒性,包括中性粒细胞计数降低、白细胞计数降低,血小板计数降低和贫血。所有患者均发生了细胞因子风暴(CRS),其中9例为I级,1例为2级CRS。无神经毒性报道。
- 临床初步疗效:
- 总体反应率(ORR)100%,其中6例达严格意义的完全缓解(sCR),4例达非常好的部分缓解(VGPR)。
- 5例BCMA CART细胞复发的患者中,2例达严格意义的完全缓解(sCR),3例达非常好的部分缓解(VGPR)。100%的患者达到MRD 10-5阴性(28天评估)。
- 中位无进展生存期(mPFS)尚未达到。到截止日期为止,2例患者出现疾病进展,其中1例为GPRC5D阳性进展,另一例为GPRC5D阴性进展。
浙江大学附属第一医院骨髓移植中心黄河教授表示:
复发难治多发性骨髓瘤临床上仍然是一种无法治愈的浆细胞恶性肿瘤。治疗方面的进展(包括免疫调节药物、蛋白酶体抑制剂和单克隆抗体的引入,以及干细胞移植)延长了患者生存期。然而,几乎所有患者最后均会复发,且具有高危细胞遗传学特征或患难治性疾病的患者的生存结局较差。我们的研究数据显示OriCAR-017对于复发难治多发性骨髓瘤是一个非常安全和有效的新的治疗手段,特别是针对BCMA靶向治疗失败的病人,其展示临床疗效令人非常振奋,期待与原启生物一同继续开展OriCAR-017的后续临床研究。
原启生物董事长杨焕凤表示:
OriCAR-017在POLARIS研究中观察到100%ORR以及可控的安全性为原启生物后续的注册临床研究提供了扎实的基础。原启生物计划正式提交OriCAR-017在中国和美国的注册临床研究申请,尽快尽早将OriCAR-017推进至关键临床研究阶段。
关于OriCAR-017
OriCAR-017是原启生物基于OriAb和OriCAR两个自主研发技术平台开发的核心产品之一,靶向GPRD5D的嵌合抗原受体T细胞治疗用于治疗复发/难治性多发性骨髓瘤(R/R MM)。
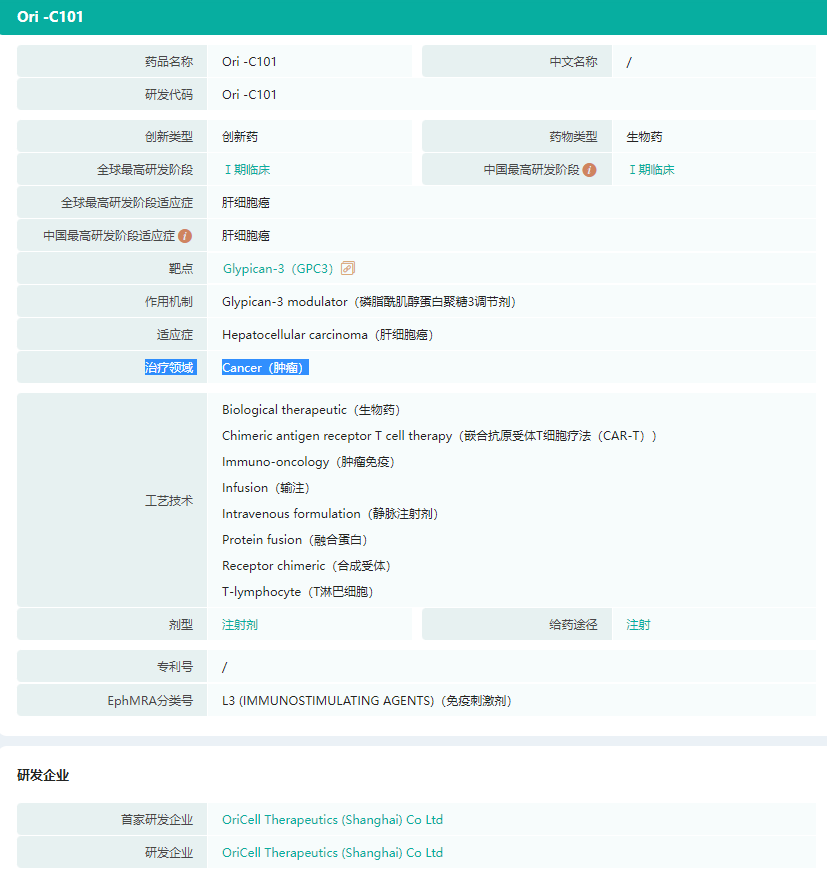
在2022年6月2022ASCO年会,原启生物口头报告了由研究者在中国开展的临床I期POLARIS临床试验数据。截止2022年04月30日,所有可评估数据显示ORR 100%,MRD 10-5阴性率100%(28天评估),包括既往BCMA CAR-T治疗失败的受试者在内的所有受试者。
2022年10月,OriCAR-017获美国FDA授予“孤儿药”资格,用于治疗复发难治性多发性骨髓瘤(《原启生物:首创GPRC5D CAR-T获美国FDA授予孤儿药资格认定》)。
目前,公司正在加速推进该产品的中美双报工作。
关于多发性骨髓瘤 (MM)
多发性骨髓瘤(MM)是最常见的血液癌症之一,是一种克隆性浆细胞异常增殖的恶性疾病。对于初治的多发性骨髓瘤患者,常用的一线治疗药物包括蛋白酶体抑制剂、免疫调节类药物及烷化剂类药物。对于大多数的患者,常用的一线治疗可以使患者的病情稳定3-5年,但也有少部分患者在初治时表现为原发耐药,病情不能得到有效控制。对于治疗有效的大多数初治患者,在经过疾病稳定期后也会不可避免的进入复发、难治阶段。因此,复发/难治多发性骨髓瘤患者仍存在未满足的需求。在美国,MM约占所有新发癌症患者人数近2%,占癌症死亡患者人数的2%以上。更多信息见:https://pubmed.ncbi.nlm.nih.gov/33498356/
关于原启生物
原启生物成立于2015年,是一家致力于自主创新技术平台开发肿瘤细胞免疫治疗产品的创新药企。截至当前,公司已经申请专利91项(包括PCT),获得授权10项。
截图来源:药融云投融资数据库
原启生物以为全球未被满足的临床需求开发效价可及的药物为使命,自主创新构建了基于肿瘤细胞免疫治疗的Ori®Ab、Ori®CAR等多个专利技术平台,并从抗体工程构建技术、肿瘤免疫微环境调节、T细胞浸润与杀伤能力等方面着手突破了CAR-T治疗实体肿瘤的疗效瓶颈。靶向GPRC5D治疗复发难治多发性骨髓瘤的产品OriCAR-017临床研究数据获2022 ASCO年会接收作口头报告,并于2022年10月获得美国FDA孤儿药认定。公司开发的首个靶向GPC-3的CAR-T产品的探索性临床研究数据积极,亮相ASCO 2021,于2022年9月获得了NMPA的IND临床试验批件;首个自主研发的免疫检查点(PD-L1/4-1BB)双特异性抗体药物YN051(ATG101)以首付款+里程碑1.42亿美金的金额授权给德琪医药(B.6996)继续开发,该项目已获得澳大利亚、美国和中国三地的注册临床试验批件,并在澳洲和中国完成了首例患者给药。
目前,原启生物已有超过10个针对肿瘤治疗的细胞药物管线(《原启生物管线梳理!10项自主创新产品齐头并进》)。重点关注包括肝癌、卵巢癌、胃癌、宫颈癌、非小细胞肺癌、多发性骨髓瘤等具有广泛的治疗需求适应症。原启生物始终秉持着“成为创新驱动的全球领先肿瘤免疫治疗新药的创制者”的企业愿景,组建了国际化产品开发和运营管理团队,建设了符合GMP规范的生产设施和质量检测及管理体系,不断通过自主创新的技术平台,探索开发疗效好、差异化、成本可及的创新型肿瘤的细胞免疫治疗药物,力争在“创新药、中国造”的发展机遇中不断开立新局。
2022年7月,原启生物宣布完成总金额超过1.2亿美元的B轮融资(《原启生物:完成超1.2亿美元B轮融资!启明创投、泉创资本共同领投》)。
原启生物投融资情况

截图来源:药融云投融资数据库
扫码立即关注
更多信息请关注访问
www.oricell.com

想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论